realizată de REYES GODINEZ JOSE ALBERTO 2 ani în urmă
269
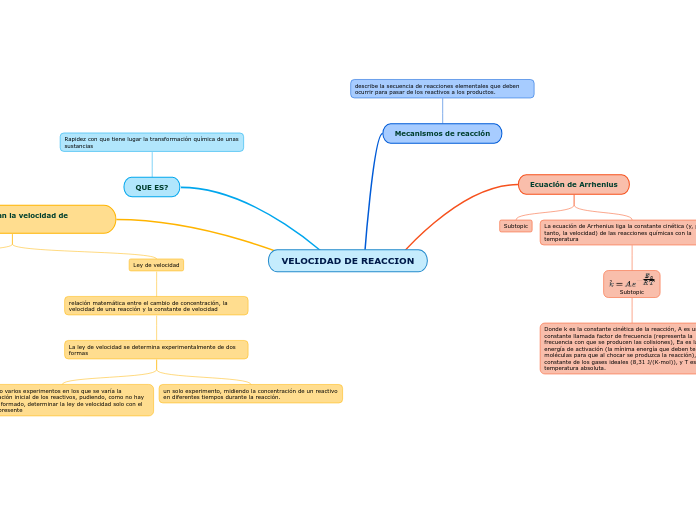
VELOCIDAD DE REACCION
La ecuación de Arrhenius es fundamental para entender cómo la temperatura afecta la velocidad de las reacciones químicas. Esta ecuación relaciona la constante cinética con la temperatura absoluta y otros factores como el factor de frecuencia y la energía de activación.