VELOCIDAD DE REACCION
Factores que afectan la velocidad de reacción
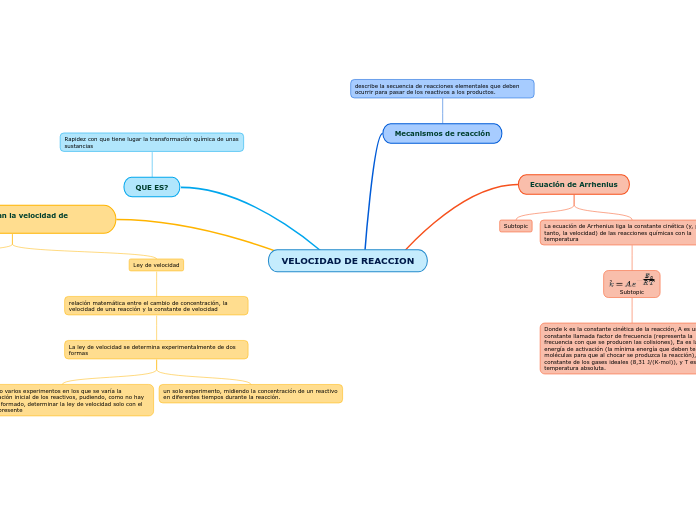
Ley de velocidad
relación matemática entre el cambio de concentración, la velocidad de una reacción y la constante de velocidad
La ley de velocidad se determina experimentalmente de dos formas
un solo experimento, midiendo la concentración de un reactivo en diferentes tiempos durante la reacción.
realizando varios experimentos en los que se varía la concentración inicial de los reactivos, pudiendo, como no hay producto formado, determinar la ley de velocidad solo con el reactivo presente
Naturaleza de los reactivos
cuando uno de los reactivos es solido, la velocidad de reaccion suele incrementarse al partirlo en varios pedazos, esto se explica porque aumenta la superficie de contacto entre el solido y los otros reactivos y, por lo tanto, tambien el numero de colisiones.
QUE ES?
Rapidez con que tiene lugar la transformación química de unas sustancias
Ecuación de Arrhenius
La ecuación de Arrhenius liga la constante cinética (y, por tanto, la velocidad) de las reacciones químicas con la temperatura
Donde k es la constante cinética de la reacción, A es una constante llamada factor de frecuencia (representa la frecuencia con que se producen las colisiones), Ea es la energía de activación (la mínima energía que deben tener las moléculas para que al chocar se produzca la reacción), R la constante de los gases ideales (8,31 J/(K·mol)), y T es la temperatura absoluta.
Subtopic
Mecanismos de reacción
describe la secuencia de reacciones elementales que deben ocurrir para pasar de los reactivos a los productos.