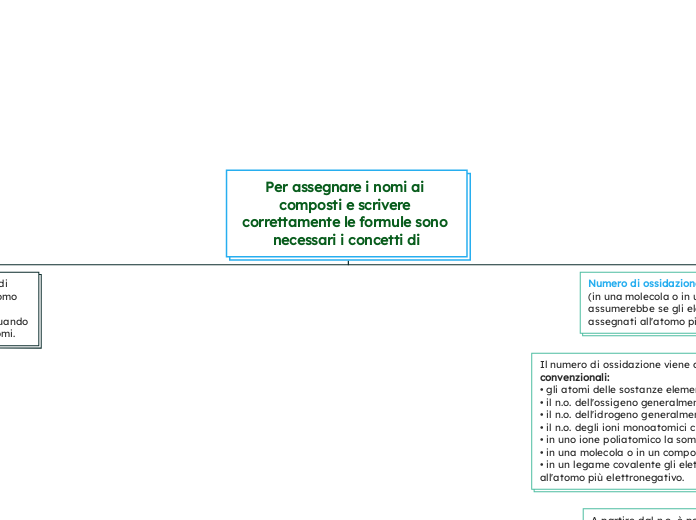
Per assegnare i nomi ai composti e scrivere correttamente le formule sono necessari i concetti di
Numero di ossidazione (n.o.): la carica che ogni atomo (in una molecola o in uno ione poliatomico) assumerebbe se gli elettroni di legame fossero assegnati all'atomo più elettronegativo.
Il numero di ossidazione viene assegnato sulla base di alcune regole convenzionali:
• gli atomi delle sostanze elementari hanno n.o. 0;
• il n.o. dell'ossigeno generalmente è - 2;
• il n.o. dell'idrogeno generalmente è + 1;
• il n.o. degli ioni monoatomici coincide con la carica elettrica;
• in uno ione poliatomico la somma dei n.o. equivale alla carica dello ione;
• in una molecola o in un composto ionico la somma dei n.o. è 0;
• in un legame covalente gli elettroni condivisi sono formalmente attribuiti all'atomo più elettronegativo.
A partire dal n.o. è possibile leggere e scrivere le formule dei composti più semplici.
Composti ternari
Sali degli ossia-cidi: es. FeSO,, tetraos-sosolfato (VI) di ferro (II), solfato ferroso
Ossiacidi:
composti acidi che in soluzione
liberano H+
(es. H2SO4, acido tetraossosolfo-
rico (VI), acido solforico).
Idrossidi:
composti basici che contengono il gruppo caratteristico OH
(es. Fe(OH)2, idrossido di ferro
(Il), idrossido ferroso).
Composti binari
dell'idrogeno.
Idruri
dei non metalli: composti dell'idrogeno con semimetalli e non metalli
(es. CH4, metano, tetraidru-
ro di carbonio; NH3, ammo-
niaca, triidruro di azoto).
dei metalli: composti dell'idrogeno (n.o. - 1) con metalli molto elettropositivi (es. BaH2, diidruro di bario, idruro di bario).
Idracidi: sono sei composti
con carattere acido costituiti da idrogeno e un non metallo
(es. HCI, cloruro di idrogeno, acido cloridrico).
Sali binari:
composti che comprendono una parte metallica e una non metallica, si ottengono da un idrossido e un idracido (es. NaCl, cloruro di sodio).
dell'ossigeno
Ossidi: composti in cui l'0 ha n.o. -2.
Ossidi acidi o anidridi: ossidi dei non metalli, con carattere acido (es. CO, monossido di car-
bonio, anidride carboniosa).
Ossidi basici: ossidi dei metalli, con carattere basico (es. CuzO, monossido di dirame,
ossido di rame (1), ossido rameoso).
Perossidi: sono
ossidi caratterizzati dal gruppo
0-0 e in cui l'ossigeno ha
n.o.-1
(es. H202, diossido di diidroge-
no, perossido di idrogeno, acqua ossigenata).
Valenza: il numero di elettroni che un atomo guadagna, perde o mette in comune quando si lega con altri atomi.