av Vanessa Escobar för 5 årar sedan
427
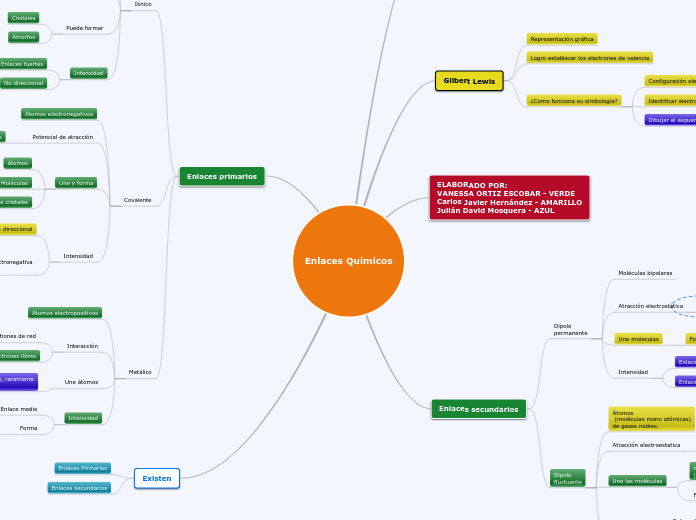
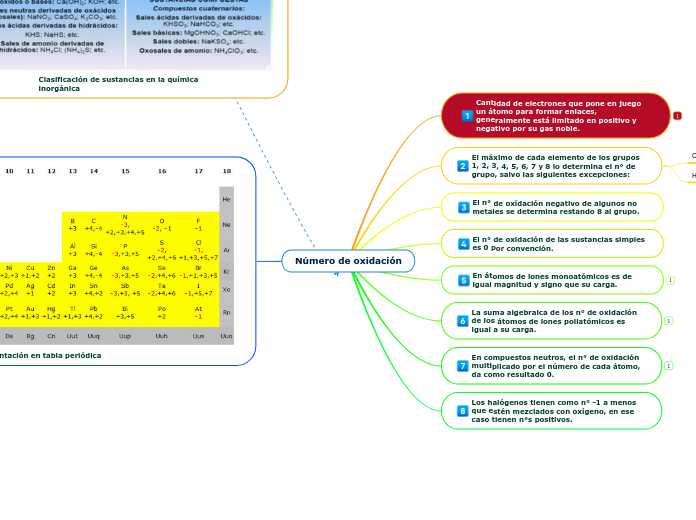
Enlaces Químicos
Existen diferentes tipos de enlaces químicos que mantienen unidos a los átomos para formar moléculas y cristales. Los enlaces primarios se clasifican en covalentes, iónicos y metálicos, cada uno con características específicas.