作者:Felipe Shai 3 年以前
233
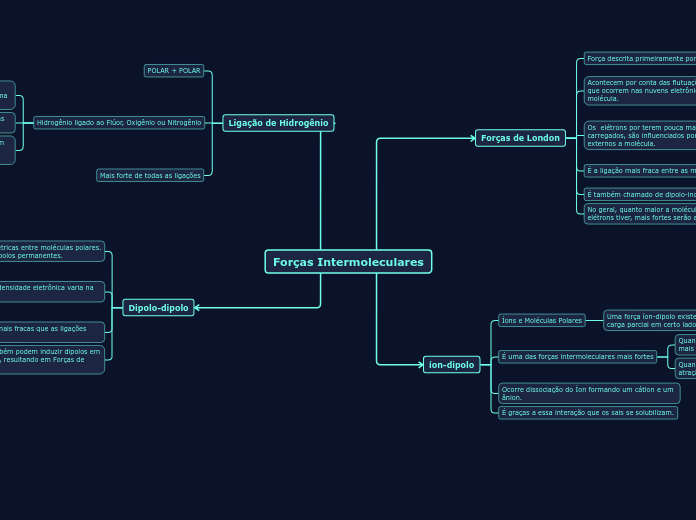
Forças Intermoleculares
As forças intermoleculares são interações que ocorrem entre moléculas e íons, influenciando propriedades físicas como a solubilidade e o ponto de ebulição. Entre elas, destacam-se três tipos principais: