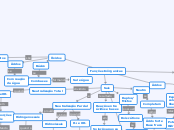
Funções inorgânicas
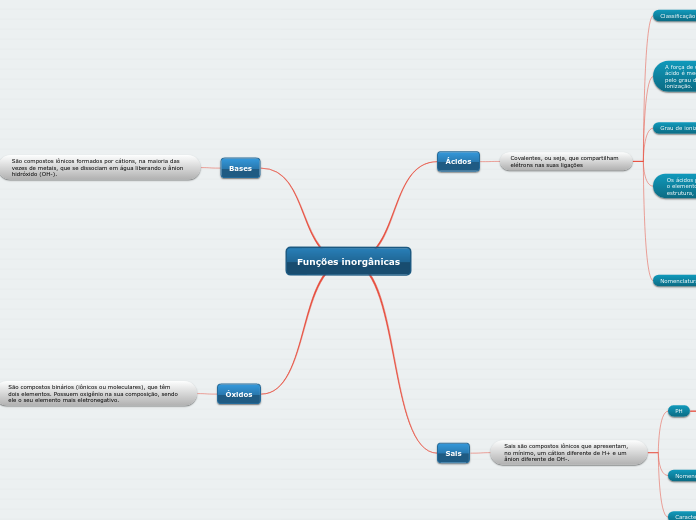
Óxidos
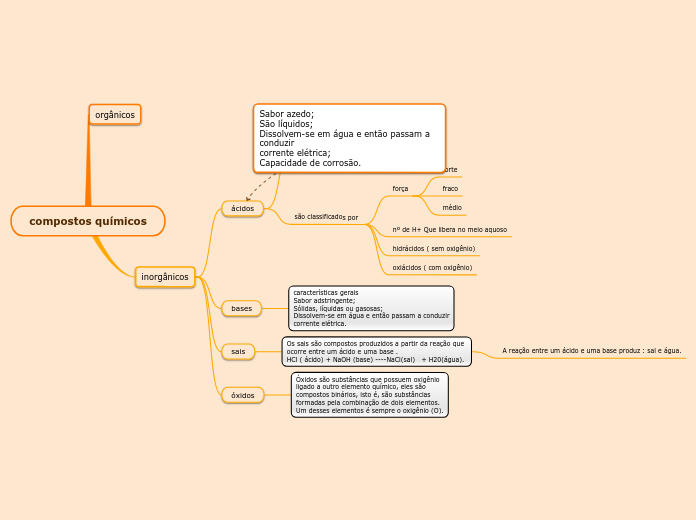
São compostos binários (iônicos ou moleculares), que têm dois elementos. Possuem oxigênio na sua composição, sendo ele o seu elemento mais eletronegativo.
Nomenclatura dos óxidos
Óxido de +nome do elemento combinado com oxigênio
Propriedades
Anfóteros
Podem se comportar como ácidos ou bases.
Peróxidos
Em solução aquosa reagem com a água ou ácidos diluídos e formam água oxigenada.
Neutros
Alguns óxidos que não reagem com a água.
Em solução aquosa reagem com a água e formam ácidos.
Básicos
Em solução aquosa alteram o pH para maior que 7.
Classificação dos óxidos
Moleculares-Combinação do oxigênio com
elementos não metálicos.
Iônicos-Combinação do oxigênio com metais.
Bases
São compostos iônicos formados por cátions, na maioria das vezes de metais, que se dissociam em água liberando o ânion hidróxido (OH-).
Nomenclatura das bases
Hidróxido de + nome do cátion
Solubilidade em água
Praticamente insolúveis: demais bases.
Pouco solúveis: bases de metais alcalinos terrosos.
Solúveis: bases de metais alcalinos e amônio.
Grau de dissociação
Fracos: possuem grau de dissociação inferior a 5%.
Fortes: possuem grau de dissociação praticamente 100%.
Quanto maior o valor de reto
alfa mais forte é a base, pois:
Alfa=número de fórmulas unitárias dissociadas/número de
fórmulas unitárias dissociadas no inicio.
Classificação das bases
Tetrabases: possuem quatro hidroxilas.
Tribases: possuem três hidroxilas.
Dibases: possuem duas hidroxilas.
Monobases: possuem apenas uma hidroxila.
Sais
Sais são compostos iônicos que apresentam, no mínimo, um cátion diferente de H+ e um ânion diferente de OH-.
Características dos sais
Sofrem ebulição em temperaturas altas.
São sólidos e cristalinos.
São compostos iônicos.
Nomenclatura dos sais
Nome do ânion+de+nome do cátion
PH
Subtópico
Sais básicos-Quando são dissolvidos em água fazem o pH da solução ficar maior que 7.
Sais ácidos-Quando são dissolvidos em água fazem o pH da solução ficar menor que 7.
Sais neutros-Quando são dissolvidos em água não alteram o pH.
Ácidos
Covalentes, ou seja, que compartilham elétrons nas suas ligações
Nomenclatura de ácidos
oso
Terminação cátion
ico
ídrico
Terminação ânion
ito
ato
eto
Os ácidos podem conter ou não o elemento oxigênio na sua estrutura, sendo assim:
Oxiácidos: O elemento oxigênio está presente na estrutura do ácido.
Hidrácidos: não apresentam átomos de oxigênio.
Grau de ionização
Fracos: possuem grau de ionização inferior a 5%.
Moderados: possuem grau de ionização entre 5% e 50%.
Fortes: possuem grau de ionização superior a 50%.
A força de um ácido é medida pelo grau de ionização.
Alfa=Número de moléculas ionizadas/número de moléculas dissolvidas
Classificação dos ácidos
Tetrácidos: possuem quatro hidrogênios ionizáveis.
Triácidos: possuem três hidrogênios ionizáveis.
Diácidos: possuem dois hidrogênios ionizáveis.
Monoácidos: possuem apenas um hidrogênio ionizável.