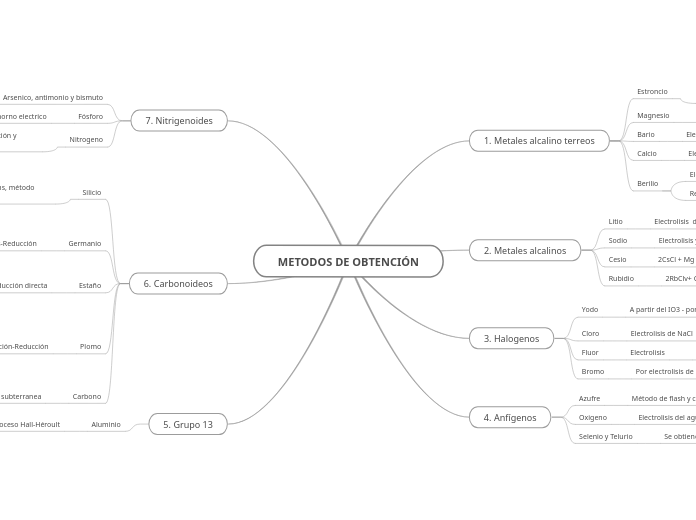
METODOS DE OBTENCIÓN
Grupo 13
Aluminio
Electrolisis por proceso Hall-Héroult
2Al2O3 + 3 C → 4 Al + 3 CO2
Carbonoideos
Carbono
Proceso productivo de mineria subterranea
Plomo
Tostación-Reducción
PbS + 2PbSO4 → Pb +3SO2 2PbO
PbS + 2PbO → 3Pb + SO2
PbS + 2O2 → PbSO4
2PbS +3O2 → 2PbO + 2SO2
Estaño
Reducción directa
SnO2 + 2CO → Sn + 2CO2
SnO2 +2C → Sn + 2CO
Germanio
Cloración-Hidrolisis-Reducción
𝐆𝐞𝐂𝐥𝟒 + 𝟐𝐇𝟐𝐎 → 𝐆𝐞𝐎𝟐 + 𝟒𝐇𝐂l
𝐆𝐞𝐫𝐦𝐚𝐧𝐢𝐭𝐚 + 𝐇𝐂𝐥 → 𝐆𝐞𝐂𝐥𝟒(𝐯𝐨𝐥á𝐭𝐢𝐥)
Silicio
Por reducción directa, proceso siemens, método dupont
SiO2 +C → Si +CO2
3SiO2 + 4Al → 3Si + 2Al2O3
SiO2+2Mg → Si + 2MgO
Nitrigenoides
Nitrogeno
A partir de la licuación, destilación, absorción y dessorcion sobre carbono activado.
Fósforo
Reducción directa con C. en horno en horno electrico
2Ca3(PO4)2 + 10C + 6SiO2 → P4 + 6CaSiO3 + 10CO
Arsenico, antimonio y bismuto
Por tostación y posterior reducción
Anfígenos
Selenio y Telurio
Se obtiene por combustion de sulfuros de Cu Ag
Oxigeno
Electrolisis del agua
H2O2 → H2O + 1/2O2
Azufre
Método de flash y contacto
Halogenos
Bromo
Por electrolisis de NaCl y agua de mar
Con corriente de Cl 𝟐𝐁𝐫− +𝐂𝐥𝟐 → 𝐁𝐫𝟐 + 𝐂𝐥 −
Fluor
2F-(g) → F2(g) + 2e-
Cloro
Electrolisis de NaCl
𝐍𝐚𝐂𝐥 𝐟𝐮𝐧𝐝𝐢𝐝𝐨 → 𝐍𝐚+ + 𝐂𝐥−
Yodo
A partir del IO3 - por reducción
IO3 − + 𝟓𝐇𝐒𝐎𝟑−⇀ 𝐈𝟐+𝟓𝐒𝐎𝟒𝟐− +𝟑𝐇+ +𝐇𝟐𝐎
Metales alcalinos
Rubidio
2RbClv+ Ca-->CaCl2+2Rb
Cesio
2CsCl + Mg --> MgCl2 + 2Cs
Sodio
Electrolisis y método de Downs
NaCl (fundido) → Na + + Cl -
Litio
Electrolisis del LiCl fundido
Metales alcalino terreos
Berilio
Electrolisis de sal fundida
BeCl2 + Ca ----> CaCl2 + Be
Calcio
Electrolisis
CaCl2: Catodo: Ca+2 +2e- =Ca Ánodo: 2Cl- + Cl2 +2e-
Bario
Electrólisis y reducción con agentes químicos
BaCl2: 3BaO +2Al --> Al2O3 +3Ba (aluminotermia)
Magnesio
Reducción con agentes químicos
MgO+C -- > CO+Mg (2000°C)
Estroncio
Electrólisis de SrCl2 fundido mezclado con KCl o aluminatermia