von Dario Franco Pineda Bermudez Vor 4 Jahren
2362
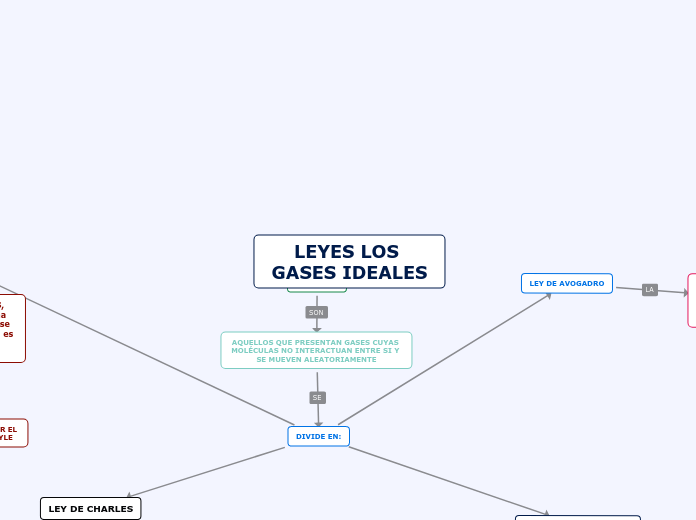
LEYES LOS GASES IDEALES
La comprensión del comportamiento de los gases ideales se basa en varias leyes fundamentales que describen cómo el volumen, la presión y la temperatura interactúan en diferentes condiciones.