ÁTOMO DA MECÂNICA QUÂNTICA
With this mind map you will be able to see the advantages and disadvantages of certain ideas!
Type in your ideas here!
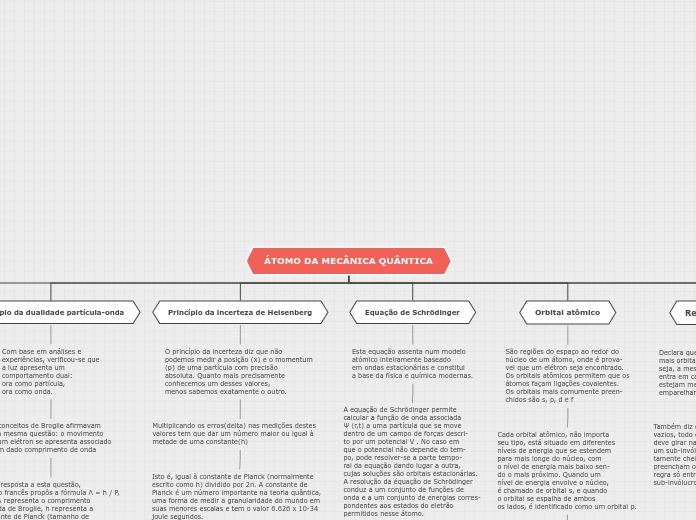
Princípio da exclusão de Pauli
Estabelece que, em um mesmo átomo
não pode haver dois elétrons com os
quatro números quânticos iguais. Assim
podem existir, em um mesmo orbital,
no máximo dois elétrons, porém com
spins contrários
Add the pro arguments!
Regra de Hund
Declara que, se houver 2 ou
mais orbitais degenerados (ou
seja, a mesma energia), um elétron
entra em cada um até que todos
estejam meio cheios antes de
emparelhar.
Também diz que, ao encher os orbitais
vazios, todo elétron não emparelhado
deve girar na mesma direção. Como
um sub-invólucro deve estar comple-
tamente cheio antes que os elétrons
preencham outros invólucros, essa
regra só entra em vigor no último
sub-invólucro preenchido.
Orbital atômico
São regiões do espaço ao redor do
núcleo de um átomo, onde é prova-
vel que um elétron seja encontrado.
Os orbitais atômicos permitem que os
átomos façam ligações covalentes.
Os orbitais mais comumente preen-
chidos são s, p, d e f
Cada orbital atômico, não importa
seu tipo, está situado em diferentes
níveis de energia que se estendem
para mais longe do núcleo, com
o nível de energia mais baixo sen-
do o mais próximo. Quando um
nível de energia envolve o núcleo,
é chamado de orbital s, e quando
o orbital se espalha de ambos
os lados, é identificado como um orbital p.
quanto maior o nível de energia,
mais alongado é o orbital.
Equação de Schrödinger
Esta equação assenta num modelo
atómico inteiramente baseado
em ondas estacionárias e constitui
a base da física e química modernas.
A equação de Schrödinger permite
calcular a função de onda associada
Ψ (r,t) a uma partícula que se move
dentro de um campo de forças descri-
to por um potencial V . No caso em
que o potencial não depende do tem-
po, pode resolver-se a parte tempo-
ral da equação dando lugar a outra,
cujas soluções são orbitais estacionárias.
A resolução da équação de Schrödinger
conduz a um conjunto de funções de
onda e a um conjunto de energias corres-
pondentes aos estados do eletrão
permitidos nesse átomo.
Princípio da incerteza de Heisenberg
O princípio da incerteza diz que não
podemos medir a posição (x) e o momentum
(p) de uma partícula com precisão
absoluta. Quanto mais precisamente
conhecemos um desses valores,
menos sabemos exatamente o outro.
Multiplicando os erros(delta) nas medições destes valores tem que dar um número maior ou igual à metade de uma constante(h)
Isto é, igual à constante de Planck (normalmente escrito como h) dividido por 2π. A constante de Planck é um número importante na teoria quântica, uma forma de medir a granularidade do mundo em suas menores escalas e tem o valor 6.626 x 10-34 joule segundos.
Princípio da dualidade partícula-onda
Com base em análises e
experiências, verificou-se que
a luz apresenta um
comportamento dual:
ora como partícula,
ora como onda.
Os conceitos de Broglie afirmavam
esta mesma questão: o movimento
de um elétron se apresenta associado
a um dado comprimento de onda
Como resposta a esta questão,
o físico francês propôs a fórmula Λ = h / P,
onde λ representa o comprimento
de onda de Broglie, h representa a
constante de Planck (tamanho de
um quantum)e P se refere ao produto
da massa pela velocidade da partícula.
Essa proposta de De Broglie para a
dualidade partícula-onda envolve não
apenas os elétrons, mas toda a matéria,
tais como prótons, nêutrons, átomos e moléculas.
Obsolescência do modelo de Rutherford-Bohr
Na conclusão de suas pesquisas e experimentos, Bohr chegou a alguns fundamentos importantes
Cada elétron tem uma órbita, ou estado estacionário, que não é fixa. É que se o elétron emite energia, ele salta para uma órbita mais afastada do núcleo. Se ele consumir energia, aumenta automaticamente o nível dessa energia. As camadas eletrônicas, ou níveis de energia, apresentam um número determinado e são denominadas pelas letras: K, L, M, N, O, P, Q.
O Modelo Atômico de Bohr funcionava perfeito quando analisava o hidrogênio, mas falhava quando se tratava de outro elemento. É que ele não explicava o espectro de raia, quando formado por elementos com mais número de elétrons. Foi por isso que, a partir da década de 1920, alguns cientistas melhoraram o Modelo Atômico de Bohr.