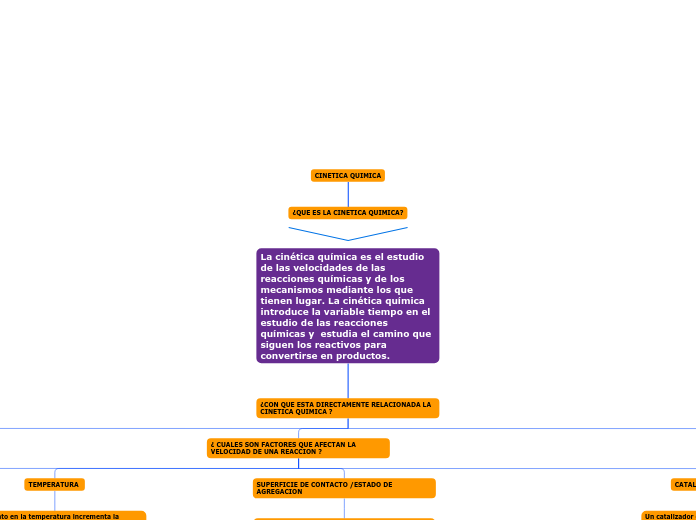
La cinética química es el estudio de las velocidades de las reacciones químicas y de los mecanismos mediante los que tienen lugar. La cinética química introduce la variable tiempo en el estudio de las reacciones químicas y estudia el camino que siguen los reactivos para convertirse en productos.
¿CON QUE ESTA DIRECTAMENTE RELACIONADA LA CINETICA QUIMICA ?
Entonces, para referirnos a una reacción química no basta solo con conocer lo que sucede a nivel atómico o macroscópico también, es necesario conocer la velocidad con la que los
reactantes se transforman en productos, estudio que lo realiza la cinética química.
¿ CUALES SON FACTORES QUE AFECTAN LA VELOCIDAD DE UNA REACCION ?
CATALIZADORES O INHIBIDORES
Un catalizador o inhibidor es una sustancia que afecta la velocidad de una reacción química pero, no participa de ella, es decir, no es parte de los reactantes.
¿CUANTOS TIPOS EXISTEN?
INHIBIDORES
Corresponden a sustancias que aumentan la energía de activación, por lo tanto, los reactantes necesitan más energía (superar una barrera más alta) para poder
transformarse en productos.
Lo que hace que la velocidad de reacción sea menor. Un
ejemplo es el ácido cítrico presente en limones y naranjas que ralentiza el proceso de
oxidación de los alimentos. Por eso, cuando te digan que le agregues limón a la Aguscate para
que no se ponga negra, lo que estamos haciendo es disminuir la velocidad de oxidación de
esta, gracias a dicho ácido.
CATALIZADORES
¿QUE SON?
Son sustancias que disminuyen la energía de activación, es decir, disminuyen la barrera energética que deben superar los reactantes.
En
consecuencia la velocidad es mayor. Un ejemplo de catalizador, son los convertidores
catalíticos utilizados en la industria automotriz, los cuales hacen que la reacción que ocurre
en el motor sea mucho más rápida.
SUPERFICIE DE CONTACTO /ESTADO DE AGREGACION
Las reacciones químicas ocurren cuando los reactantes entran en contacto. Debido a ello, se
deben considerar 2 aspectos diferentes:
SUPERFICIE DE CONTACTO
¿Qué pasa cuando uno de los reactantes es sólido?, ¿puedo hacer que la reacción sea más rápida?
Efectivamente, para eso lo que podemos hacer es aumentar la superficie de contacto, con el objetivo de que las moléculas tengan una mayor superficie para poder reaccionar.
¿COMO SE LOGRA?
Una manera fácil de lograr esto, es moler los sólidos, es decir, dividirlos finamente. Gracias a eso, la superficie de contacto es mayor, lo que facilita la interacción para romper y formar
nuevos enlaces entre las moléculas que reaccionarán y así, obtener los productos de la reacción.
ESTADO DE AGREGACION
Si se analizan las características de los diversos estados de agregación (sólido, líquido y gas), se puede establecer que mientras más movimiento tengan las partículas, la reacción tendrá más probabilidad de llevarse a cabo.
TEMPERATURA
Un aumento en la temperatura incrementa la energía cinética de las moléculas que al moverse
con mayor rapidez, chocan con más frecuencia y con mayor energía.
¿QUE IMPLICA?
que la reacción sí o sí se lleve a cabo
Como la energía cinética de las moléculas depende de la temperatura, se puede establecer que la velocidad de una reacción es directa a este factor, es decir, si uno aumenta el otro también y, viceversa.
CONCENTRACION
Todas las reacciones químicas se llevan a cabo con más rapidez si se aumenta la
concentración de uno o más, de los reactivos. A medida que la concentración aumenta, la
probabilidad de que dichas moléculas choquen aumenta y, con ello aumenta también, la
probabilidad de que estos choques sean efectivos originando velocidades mayores.
POR EJEMPLO
Si pudiéramos observar microscópicamente lo que ocurre en rxs que dependen de la concentración, tendríamos una mayor cantidad de reactivos (moléculas que reaccionarán) en un
mismo volumen, por ende, habría menos espacio intermolecular. Aún así, las moléculas seguirían en movimiento y, como el espacio es reducido, habría una mayor probabilidad de chocar efectivamente, por lo que la reacción se llevaría a cabo de una manera más rápida.
LA VELOCIDAD DE REACCION
¿QUE ES ?
La velocidad de reacción es la rapidez con la que una reacción química ocurre
ES DECIR
cantidad de reactivos que se consumen o productos que se forman por unidad de tiempo.
¿QUE SE PUEDE EXPRESAR DE LA SIGUIENTE FORMa?
Estas manifestaciones de las reacciones químicas pueden producirse muy rápidamente o bien de manera muy lenta.
CINETICA QUIMICA
¿QUE ES LA CINETICA QUIMICA?