arabera Ana Guantá 3 years ago
151
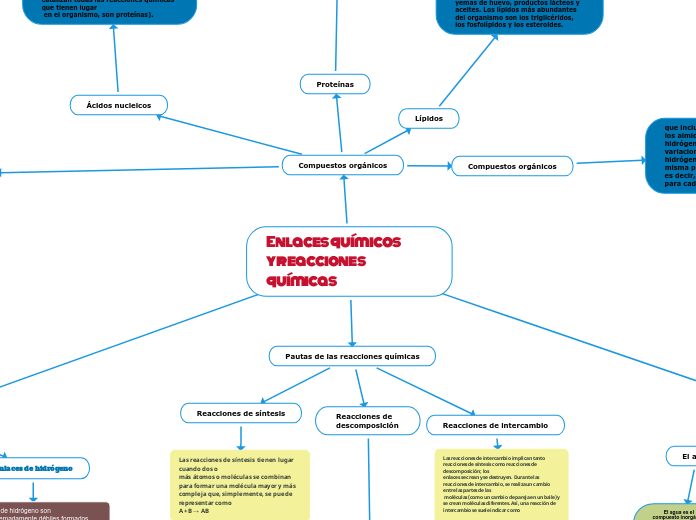
Enlaces químicos y reacciones químicas
Los enlaces químicos y las reacciones químicas son fundamentales en la bioquímica, ya que determinan la composición de la materia viva. Los ácidos y las bases, al igual que las sales, son electrolitos que se ionizan y disocian en agua, permitiendo la conducción de corriente eléctrica.