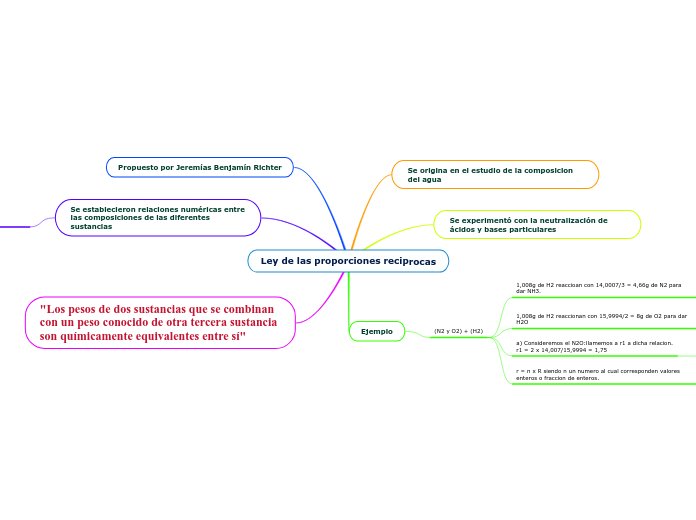
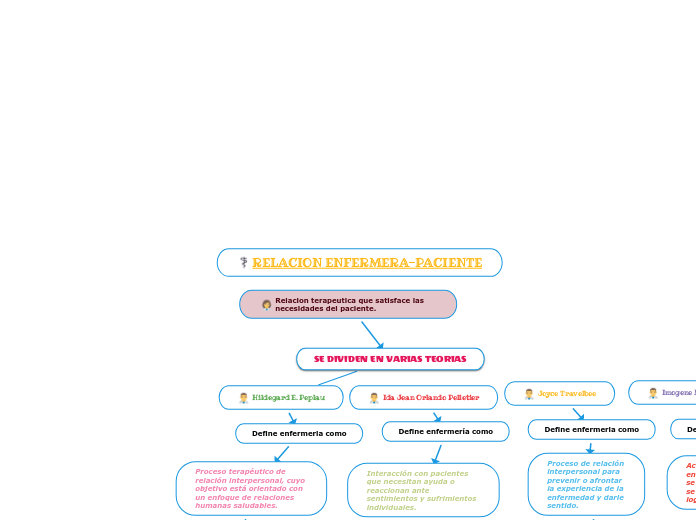
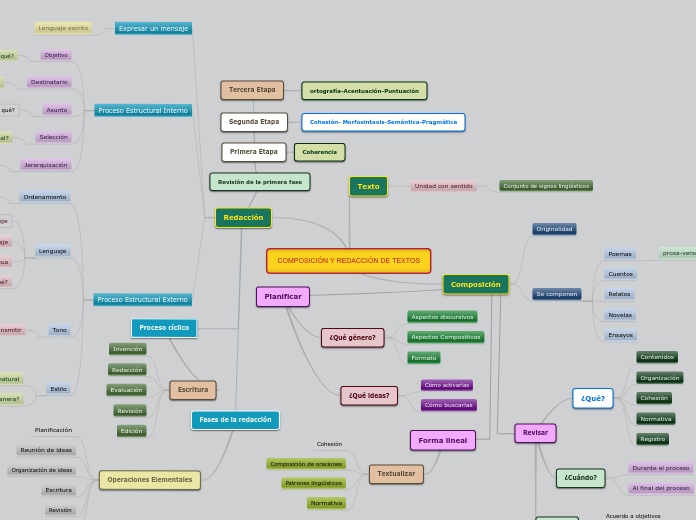
Ley de las proporciones reciprocas
"Los pesos de dos sustancias que se combinan con un peso conocido de otra tercera sustancia son químicamente equivalentes entre sí"
Se establecieron relaciones numéricas entre las composiciones de las diferentes sustancias
Debido a la ley de las proporciones múltiples algunos elementos tienen varios equivalentes.
Propuesto por Jeremías Benjamín Richter
Ejemplo
(N2 y O2) + (H2)
r = n x R siendo n un numero al cual corresponden valores enteros o fraccion de enteros.
1,75 = n1 x 0,583; n1 = 1,75 /0,583= 3
0,875 = n2 x 0,583; n2 = 0,875 /0,583= 1,5
a) Consideremos el N2O:llamemos a r1 a dicha relacion.
r1 = 2 x 14,007/15,9994 = 1,75
b) Consideremos el NO: llamemos a r2 a dicha relacion
r2 = 14,007/15,9994 = 0,875
1,008g de H2 reaccionan con 15,9994/2 = 8g de O2 para dar H2O
el nitrógeno y el oxígeno pueden reaccionar entre si para formar hasta cinco compuestos diferentes, analicemos en alguno de ellos la relacion de combinación nitrógeno/oxígeno.
1,008g de H2 reaccioan con 14,0007/3 = 4,66g de N2 para dar NH3.
Llamemos R a la relación entre el peso de nitrógeno y el peso de oxígeno que reaccionan con un peso dado de hidrógeno: R = 4,66/8 = 0,583.
Se experimentó con la neutralización de ácidos y bases particulares
Se origina en el estudio de la composicion del agua