ENERGÍA EN LAS REACCIONES QUÍMICAS
Leyes de la Termodinámica
Tercera Ley
Dice que si la entropía se tomase como cero en el cero absoluto de temperatura, cada sustancia tiene una entropía finita y positiva, pero en el cero absoluto de temperatura la entropía puede llegar a ser cero y eso lo convierte en el caso de una sustancia cristalina perfecta
Segunda Ley
Enunciado de Kelvin - Planck
Todo el trabajo mecánico puede transformarse en calor. Pero no es posible diseñar una máquina térmica capaz de convertir todo el calor absorbido en trabajo.
Enunciado de Clausius
No hay ningún proceso cuyo único resultado sea la extracción de calor de un cuerpo frío a otro más caliente.
Primera Ley
Es un principio que refleja la conservación de la energía en el contexto de la termodinámica y establece que si se realiza trabajo sobre un sistema o bien este intercambia calor con otro, la energía interna del sistema cambiará. Visto de otra forma, esta ley permite definir el calor como la energía necesaria que debe intercambiar el sistema para compensar las diferencias entre trabajo y energía interna. En palabras simples: la energía total del universo se mantiene constante. No se crea ni se destruye, solo se transforma
Ley Cero
Dice que dos sistemas que están en equilibrio térmico con un tercero están en equilibrio entre sí. Tendencia de los cuerpos calientes de difundir su energía a los cuerpos más fríos
Energía Libre de Gibbs
Hace referencia a la energía disponible para realizar otras formas de trabajo en los alrededores. El cambio de energía libre de Gibbs es una función de estado, porque se define en función de propiedades termodinámicas, como son la entalpia y la entropía, que a su vez son funciones de estado. A determinada temperatura, el cambio de energía libre de Gibbs que sucede mediante una reacción se expresa mediante la siguiente ecuación:
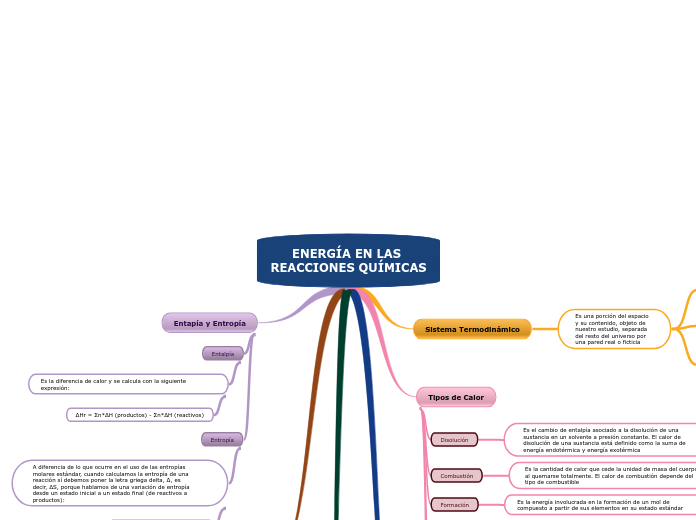
Entapía y Entropía
Entropía
A diferencia de lo que ocurre en el uso de las entropías molares estándar, cuando calculamos la entropía de una reacción sí debemos poner la letra griega delta, Δ, es decir, ΔS, porque hablamos de una variación de entropía desde un estado inicial a un estado final (de reactivos a productos):
ΔSr = Sproductos – Sreactivos
Entalpía
Es la diferencia de calor y se calcula con la siguiente expresión:
ΔHr = Σn*ΔH (productos) - Σn*ΔH (reactivos)
Variables de estado (Funciones de estado)
Son variables físicas cuyo valor depende exclusivamente del estado del sistema (condición actual) en estudio y no como se llegó a tal estado
Temperatura
Efecto de la temperatura en la espontaneidad de las reacciones
Cuando tenemos temperaturas distintas a 25°C, el sistema sufrirá algunos cambios. Cuando la temperatura aumenta, el signo de ΔG° variará, y por lo tanto el sentido en el que la reacción avanza espontáneamente, puede cambiar o no, dependiendo de los signos de ΔH° y ΔS°
ΔG = ΔH – TΔS
Volumen
Presión
Masa
Tipos de Calor
Neutralización
Es el calor producido en la reacción de neutralización de un mol de ácido, en solución acuosa, por un mol de una base también en solución
Reacción
Es una medida útil para calcular la cantidad de energía por mol que se libera o se produce en una reacción
Exotérmica
Es aquella que desprende energía térmica al medio, de modo que ocurre un aumento de temperatura a su alrededor
Endotérmica
Es aquella que absorbe energía térmica del medio, lo cual se evidencia por un descenso de la temperatura a su alrededor o por el hecho de suministrarle energía térmica a la reacción para que ocurra
Formación
Es la energía involucrada en la formación de un mol de compuesto a partir de sus elementos en su estado estándar
Combustión
Es la cantidad de calor que cede la unidad de masa del cuerpo al quemarse totalmente. El calor de combustión depende del tipo de combustible
Disolución
Es el cambio de entalpía asociado a la disolución de una sustancia en un solvente a presión constante. El calor de disolución de una sustancia está definido como la suma de energía endotérmica y energía exotérmica
Sistema Termodinámico
Es una porción del espacio y su contenido, objeto de nuestro estudio, separada del resto del universo por una pared real o ficticia
Aislado
Es el sistema que no intercambia ni materia ni ningún tipo energía con su entorno
Cerrado
Es el sistema que puede intercambiar energía, pero no materia con el exterior
Abierto
Es el sistema que puede intercambiar materia y energía