Balanceo de ecuaciones químicas
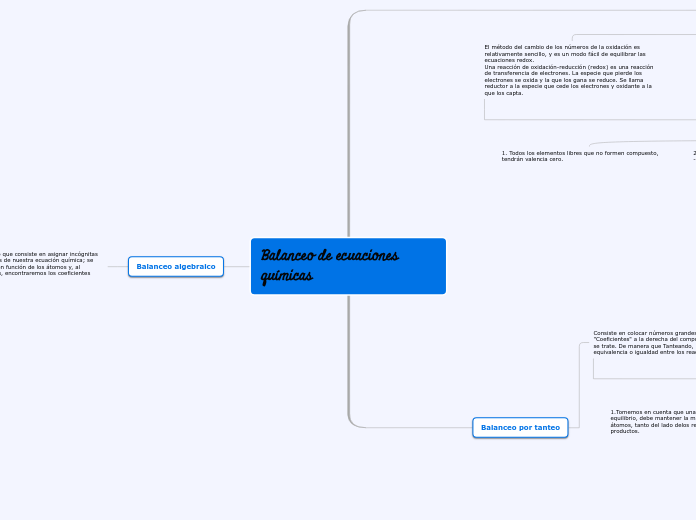
Balanceo algebraico
Es un método matemático que consiste en asignar incógnitas a cada una de las especies de nuestra ecuación química; se establecerán ecuaciones en función de los átomos y, al despejar dichas incógnitas, encontraremos los coeficientes buscados.
Ejemplo con sus respectivos pasos:
Balancear la siguiente la siguiente ecuación:
C6 H12 O6+O2→CO2+H2 O
Paso5:
Simplificar lo posible
C6 H12 O6+6O2→6CO2+6H2 O
Paso 4:
Asignar a cada de una de las especies el valor encontrado para cada una de las variables.
2C6 H12 O6+12O2→12CO2+12H2 O
Paso 3:
Utilizando esas ecuaciones da un valor arbitrario a cualquier incógnita (empieza probando con el 1 o con el 2) esto nos permitirá despejar las incógnitas de las demás ecuaciones.
6a=c
12a=2d
6a+2b=2c+d
a=2
6a=c
6(2)=c
c=12
12a=2d
12(2)=2d
24=2d
24/2=d
d=12
6a+2b=2c+d
6(2)+2b=2(12)*12
12+2b=24*12
2b=36-12
2b=24
24/2=b
b=12
Paso 2:
Multiplicar la cantidad de átomos de cada elemento de cada elemento por la incógnita asignada, para establecer las ecuaciones: el símbolo produce (→) equivale al signo (=).
C=6a=c
H=12a=2d
O=6a+2b=2c+d
Paso 1:
Asignar la incógnita (puede empezar con “a” sobre las especies de la ecuación
(a)C6 H12 O6+(b)O2→(c)CO2+(d)H2O
Balanceo por tanteo
Consiste en colocar números grandes denominados "Coeficientes" a la derecha del compuesto o elemento del que se trate. De manera que Tanteando, logremos una equivalencia o igualdad entre los reactivos y los productos.
PASOS Y REGLAS
EJEMPLO:
Fe + H2SO4 → Fe2 (SO4)3 + H2
En este caso empezaremos balanceado el metal (el hierro).
2Fe + H2SO4 → Fe2 (SO4)3 + H2
Luego el no metal (azufre)
2Fe + 3H2SO4 → Fe2 (SO4)3 + H2
Para luego balancear el oxígeno y el hidrógeno.
2Fe + 3H2SO4 → Fe2 (SO4)3 + 3H2
4. Si de un lado existe una cantidad impar, y del otro lado par, es factible convertir la cantidad impar en par multiplicándola por 2, para así obtener los respectivos coeficientes.
3.- Se recomienda comenzar en el siguiente orden:metales, no metales, oxígeno y por último hidrógeno
2.- Si existe mayor cantidad de átomos de x elemento de un lado, se equilibra completando el número de átomos que tenga en el otro lado de la reacción.
1.Tomemos en cuenta que una reacción química al estar en equilibrio, debe mantener la misma cantidad de moléculas o átomos, tanto del lado delos reactivos como del lado de los productos.
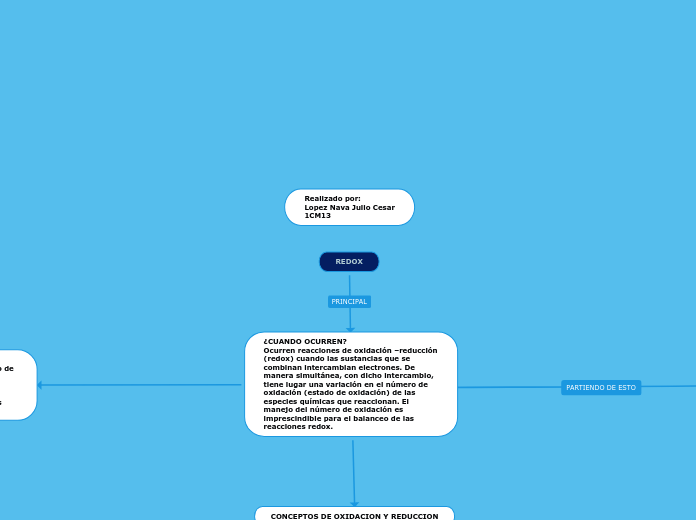
Balanceo por redox
El método del cambio de los números de la oxidación es relativamente sencillo, y es un modo fácil de equilibrar las ecuaciones redox.
Una reacción de oxidación-reducción (redox) es una reacción de transferencia de electrones. La especie que pierde los electrones se oxida y la que los gana se reduce. Se llama reductor a la especie que cede los electrones y oxidante a la que los capta.
PASOS O REGLAS
EJEMPLO
Zn + AgNO3 → Zn(NO3)2 + Ag
Estados de oxidación:
Reducción: Ag pasa de estado de oxidación + 1 a 0
Oxidación: Zn pasa de estado de oxidación 0 a +2
Semireacciones:
Zn → Zn+2 + 2e-
2 Ag+ + 2e- → 2Ag
Reacción global:
Zn + 2 Ag+ + 2e- → Zn+2 + 2Ag + 2e-
Reacción ajustada:
Zn + 2 AgNO3 → Zn(NO3)2 + 2Ag
8. Si algún átomo se oxida su numero de oxidación aumenta y cuando un átomo se reduce, su numero de oxidación disminuye
7. La suma de los números de oxidación de todos los átomos de un compuesto es igual a la carga de los compuestos.
6. Los halógenos tienen en sus compuestos con aluros oxidación -1
5. Los alcalinotérreos tienen en sus compuestos oxidación +2
4. Los alcalinos tienen en sus compuestos oxidación +1
3. El oxígeno tendrá valencia de 2- excepto en los peróxidos con -1
2. El hidrógeno tendrá valencia de +1 excepto en hidruros con -1
1. Todos los elementos libres que no formen compuesto, tendrán valencia cero.