REACCIONES QUÍMICAS+TERMOQUÍMICA
REACCIONES QUÍMICAS
4. Química e indústria.
4.3. Siderurgia:
Proceso de obtención del acero:
Distribución de las aplicaciones del acero:
Industria del automóvil (14%)
Artículos metálicos (8%)
Otras industrias (25%)
Ingeniería (25%)
Construcción (28%)
Se obtiene reduciendo la proporción de carbono hasta el 0.04% y 1,08% en masa en el arrabio en un alto horno.
Proceso de obtención de hierro:
El hierro es más usado que la suma de todos los otros metales.
Es el segundo metal en abundancia en la corteza de la Tierra.
Se usa un alto horno y carbón o coque
Procesos para obtener hierro y sus aleaciones.
4.2. Industrias del azufre:
Aplicaciones del ácido sulfúrico:
Procesado de metales (10%)
Fertilizantes (50%)
Fosfatos (6%)
Fibras (5%)
HF (2%)
Pinturas (2%)
Papel (1%)
Otros (24%)
Sustancia química más producida del mundo (250 Mt en 2020)
Proceso de obtención del ácido sulfúrico:
Método de contacto (inventado en 1901 y usado actualmente)
Se emplea azufre y aire.
4.1. Industrias del nitrógeno.
Obtención amoniaco
Aplicaciones del amoniaco:
Fertilizantes (85%)
Otros usos (5%)
Ácido nítrico (5%)
Poliamidas (5%)
Se hace a través del proceso Haber-Bosch
La segunda fabricación más importante del mundo.
A veces se realizan reacciones químicas a escala industrial y de ahí sale la industria química.
Estas se distribuyen en 3 sectores: ( el porcentaje es el valor de producción de cada uno)
Química de la salud (26%)
Química básica (41%)
Química para la industria y el consumo (33%)
La química nos permite obtener sustancias que no existen en la naturaleza o que existe menos cantidad de la que queremos.
3. Rendimiento de una reacción.
3.2. Cálculo de la energía que acompaña a una reacción.
3.1. Cálculos en procesos con rendimiento inferior al 100%.
Se llama rendimiento de una reacción a:
Rendimiento= (cantidad que se obtiene/ cantidad que se debería obtener) · 100
2. Estequiometría de las reacciones químicas.
2.3. Cálculos con un reactivo limitante.
Primero tienes que averiguar cuál es el RL y a partir de ahí hacer reglas de 3 hasta saber la cantidad de sustancias que reaccionan y las que se producen (se encuentran limitadas y no se usan enteras)
El reactivo que se agota se denomina reactivo limitante (RL).
Es el que determina la cantidad de otras sustancias que reaccionan y las que se producen.
2.2. Cálculos estequiométricos en una reacción.
Cálculos con reactivos con determinada riqueza.
5. Expresa la cantidad de sustancia en la unidad que te pidan.
4. Calcula la cantidad de sustancia usando la proporción que indican los coeficientes estequiométricos.
3. Expresa en mol la cantidad de sustancia.
2. Debajo de cada sustancia escribe sus datos.
1. Escribe la ecuación química y ajústala.
2.1. Cálculos de materia en las reacciones químicas.
Se puede medir la cantidad de sustancia que participa en un proceso en:
Volumen o temperatura (gas)
Para determinar la cantidad de un gas se usan medidas indirectas:
Volumen del recipiente
Temperatura
Volumen (líquido)
Cuando en una reacción interviene una sustancia en disolución y de molaridad conocida, se podrá determinar la cantidad de sustancia que participa gracias a la concentración molar y el volumen.
Para conocer la masa equivalente a un determinado volumen de líquido, usamos la densidad.
El líquido no siempre es una sustancia pura, sino una disolución con determinada riqueza.
Masa (sólido)
Una muestra de una sustancia sólida puede venir mezclada con otras, en ese caso se dice que tiene un porcentaje de riqueza.
Hay que determinar la cantidad de sustancia pura ( en masa).
Los cálculos que relacionan las cantidades de las sustancias que intervienen en una reacción química se llaman cálculos estequiométricos.
1. Introducción. Concepto de reacción.
Subtopic
1.5. La velocidad de las reacciones químicas.
Catalizadores
Son sustancias que alteran la velocidad de la reacción, normalmente la aumentan.
Al final del proceso el catalizador se recupera en el estado que estaba al comenzar.
Grado de división:
Cuanto menor sea el tamaño de las partículas que forman los reactivos, mayor es la velocidad de la reacción.
Concentración:
Un aumento en la concentración de los reactivos hace que aumente la velocidad de reacción y una disminución la retarda.
Temperatura:
Un aumento de temperatura hace que aumente la velocidad de una reacción y una disminución hace que se retarde.
Es la rapidez en la que los reactivos se transforman en productos.
1.4. El ajuste de las ecuaciones químicas.
En las reacciones de combustión, el combustible reacciona con el comburente ( suele ser oxígeno) y desprende energía.
Normalmente el combustible es un compuesto orgánico que cuando reacciona con 02 forma CO2 y H2O.
En las acciones de neutralización un ácido reacciona con una base. Si esta base es hidróxido, el resultado es una sal y agua.
En estas reacciones se tienen que combinar tantos H+ de ácido como OH- des hidróxido.
Es encontrar los coeficientes que indican qué proporción interviene para cada sustancia para que se cumpla que el mismo números de átomos de un elemento estén tanto en los reactivos como en los productos.
Se lee de izquierda a derecha, indicando el número de moles, el compuesto y el estado en el que se encuentra, al haber nombrado primero los reactivos (x reacciona con x), para empezar con los productos se dice: "para dar..."
1.3. Ecuaciones químicas
A la derecha se indica en qué estado está la sustancia:
Disolución acuosa (aq)
Gas (g)
Líquido (l)
Sólido (s)
A la izquierda de cada número se escribe su coeficiente estequiométrico, un número que indica la proporción en moléculas o moles (si es 1 no se escribe).
A la izquierda se escriben las fórmulas de los reactivos y a la derecha las de los productos. Y entre ambas, una flecha que indica el sentido en el que se produce la reacción.
Es una representación simbólica de una reacción química.
1.2. Reacciones químicas
Cuando se produce una reacción química se rompen los enlaces que unen los átomos de los reactivos, que al ser libres, se reordenan para formar los productos de esta reacción.
1.1. El mol
Un mol es una cantidad de sustancia cuya masa, en gramos, coincide con el valor numérico de la masa de una partícula de esa sustancia (en u).
En un mol de sustancia hay 6,022·10^23 partículas.
Es un factor que relaciona la unidad de masa atómica y el gramo.
Termodinámica química:
5. Energía libre de Gibbs
ΔG=ΔH-T·ΔS
ΔG: Cuando: ΔG<0 Espontánea; ΔG> 0 No espontánea; ΔG= Equilibrio
Una reacción es espontánea cuando:
Es exotérmica y dismunuye el desorden, siendo la temperatura baja.
Es endotérmica y aumenta el desorden mientras la temperatura es alta.
Es exotérmica y aumenta el desorden
Se mide en J
Mide la espontaneidad de una reacción
4. Entropía
ΔS= ΔQ/T
Entropía estándar de una reacción.
Diferencia entre las entropías de los productos y las de los reactivos, medidos a condiciones estándar.
Mide el grado de desorden en las que las partículas (átomos, moléculas, etc.) se distribuyen en un volumen determinado.
Cuanto más desorden más entropía
Los gases están más desordenados que los líquidos, que están más desordenados que los sólidos.
Se mide en J/K
3. Entalpía. Ley de Hess.
3.3. Ley de Hess
1. Ajustar reacciones y entalpías.
2. Escribir la fórmula de la reacción principal.
3. Suma las ecuaciones para que quede la principal.
4. Suma las entalpías.
Cuando una reacción se obtiene en varias etapas, la entalpía de reacción es la suma de las entalpías de cada una de las etapas.
3.2. Entalpías
Entalpía de enlace
Calor que interviene cuando se forma o rompe 1 mol de enlaces a partir de átomos en estado gaseoso.
Estándar de combustión
Calor que interviene al quemar q mol de compuesto.
Entalpía de reacción
Es la diferencia de las entalpías de los productos y de los reactivos.
Estándar de formación
Es el calor que interviene en la formación de 1 mol de compuesto.
Calor de la reacción a presión constante. ΔH=Q; H=U+P·V
3.1. Calor de reacción
Reacciones exotérmicas.
Son las que desprenden energía. ΔH<0
Reacciones endotérmicas.
Son las que absorben energía. ΔH>0
2. Primer principio de la termodinámica.
2.3. Procesos termodinámicos
Isobárico P=cte
Sabiendo que H= U+P·V
ΔU=Q+W; ΔU= Q+(-P·ΔV); Q= (ΔU+P·ΔV); Q= ΔH
Adiabático Q=cte; Q= 0
ΔU= Q+W; ΔU=0+W; ΔU=W
Isocórico V=cte; ΔV= 0
Si ΔV=0, W=0; W=-P·ΔV = 0
ΔU=Q+W; ΔU=Q+0; ΔU=Q
Isotérmico T=cte; ΔT= 0
Si ΔT= 0, ΔU= 0
ΔU=Q+W; 0=Q+W; Q=-W
2.2. Energía interna
Criterio de signos
En los sistemas cerrados
ΔU=Q+W
Es la suma de todas las energías dentro de el sistema
2.1. Conservación de la energía
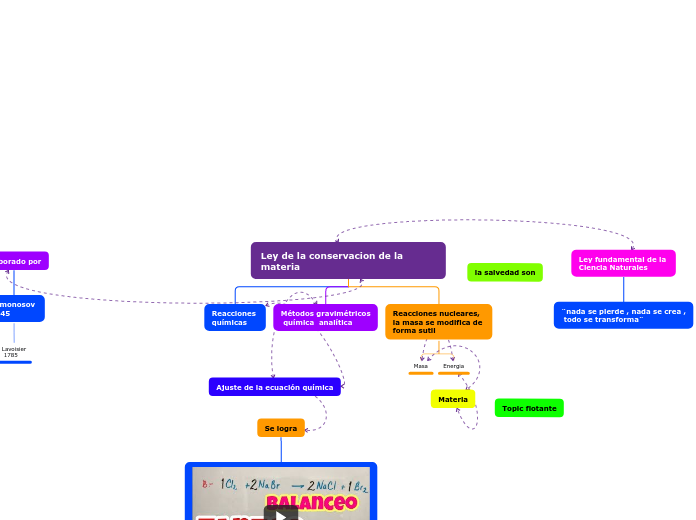
La energía ni se crea ni se destruye
La energía intercambiada por un sistema durante un proceso es la misma que la intercambiada por el entorno en ese entorno.
ΔE sistema+ΔE entorno = 0
1. Introducción. Sistemas termodinámicos.
1.3. Otros conceptos
Funciones de estado
Son aquellas variables termodinámicas que tienen un valor definido para cada estado del sistema,
y sus variaciones solo dependen del estado inicial y final.
Presión
Volumen
Tempertura
Condiciones estándar
Son las condiciones en las que se miden las variables
termodinámicas para relacionarlas entre sí
T= 25ºC
P= 1 atm
Transformaciones termodinámicas
Irreversibles
No puede volver a la situación anterior.
Reversibles
Puede volver a la situación anterior
Variables termodinámicas
Informan de la situación del sistema en todo momento.
Intensivas
No dependen de la cantidad de materia. (Ejemplo= densidad, temperatura,etc.)
Extensivas
Dependen de la cantidad de materia. (Ejemplo= masa, volumen,etc.)
Sistemas termodinámicos
Conjunto de componentes que se relacionan entre sí compartiendo materia, energía y información.
Aislados
No intercambian ni energía ni materia.
Cerrados
Intercambian energía pero no materia.
Abiertos
Intercambia materia y energía con el sistema y el entorno.
Termoquímica
Rama de la termodinámica que se centra en el estudio de las reacciones químicas.
Termodinámica
Ciencia que estudia los cambios de energía en los procesos físicos-químicos.
1.2. El trabajo
Es la transmisión de energía entre dos sistemas gracias a procesos donde intervienen desplazamientos y fuerzas.
1.1. El calor y su equivalente mecánico.
Equivalente mecánico del calor
1 cal=4,18 J
Calor específico y calor latente (Calor latente es el que se necesita para cambiar de estado)
Calor específico
El calor (Q) es la transmisión de energía entre dos sistemas cuando tienen distintas temperaturas