arabera GUZMAN MUNOZ GUZMAN MUNOZ 4 years ago
316
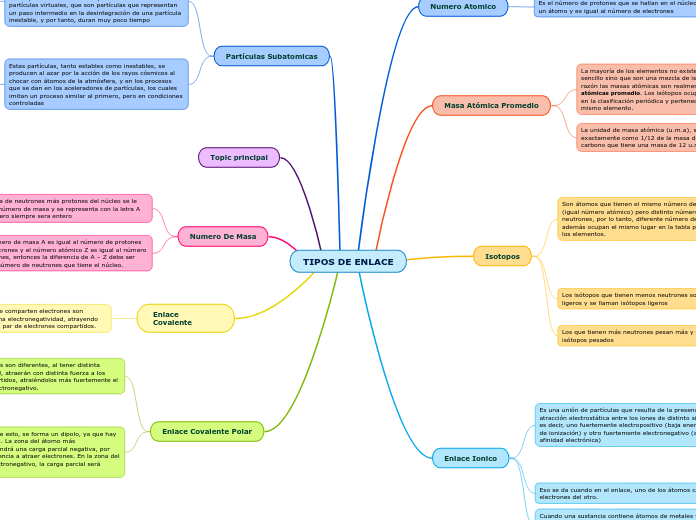
TIPOS DE ENLACE
Existen diferentes tipos de enlaces químicos y cada uno tiene características específicas según la electronegatividad de los átomos involucrados. El enlace covalente polar ocurre cuando los átomos tienen distinta electronegatividad, lo que genera una distribución desigual de los electrones compartidos y la formación de dipolos.