jonka COBRA GAMER 3 vuotta sitten
328
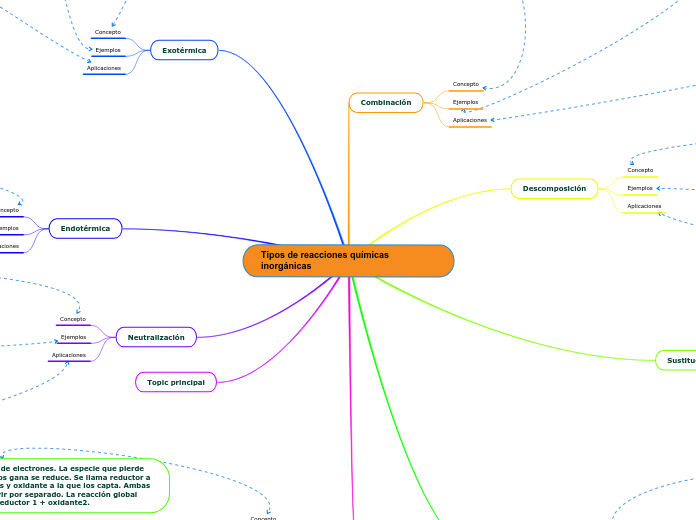
Tipos de reacciones químicas inorgánicas
Las reacciones de combustión son esenciales tanto para la generación de electricidad en plantas como para el funcionamiento de motores en vehículos que usan combustibles fósiles. Además, las reacciones redox permiten obtener elementos puros como la plata y las sales.