par samuel silva Il y a 4 années
1015
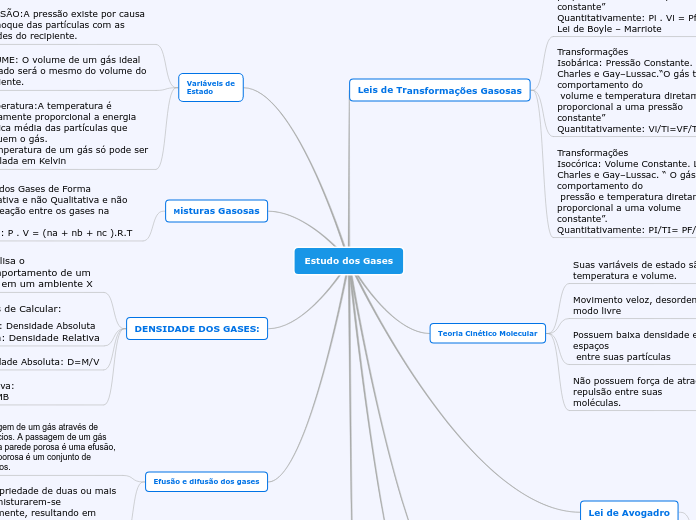
Estudo dos Gases
Os gases possuem diversas propriedades fundamentais que determinam seu comportamento. A pressão, por exemplo, resulta dos choques das partículas com as paredes do recipiente. A temperatura é proporcional à energia cinética média das partículas, sendo calculada em Kelvin.