av samuel silva för 4 årar sedan
1012
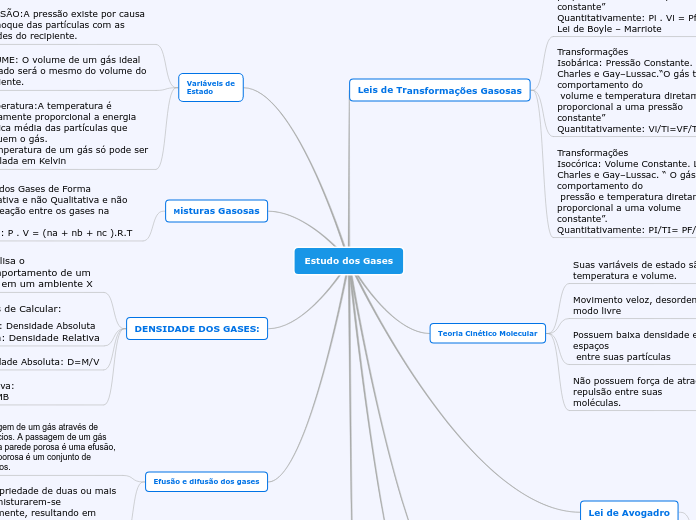
Estudo dos Gases
Os gases possuem diversas propriedades fundamentais que determinam seu comportamento. A pressão, por exemplo, resulta dos choques das partículas com as paredes do recipiente. A temperatura é proporcional à energia cinética média das partículas, sendo calculada em Kelvin.