par Athéa Gonin-Bernard Il y a 3 années
1001
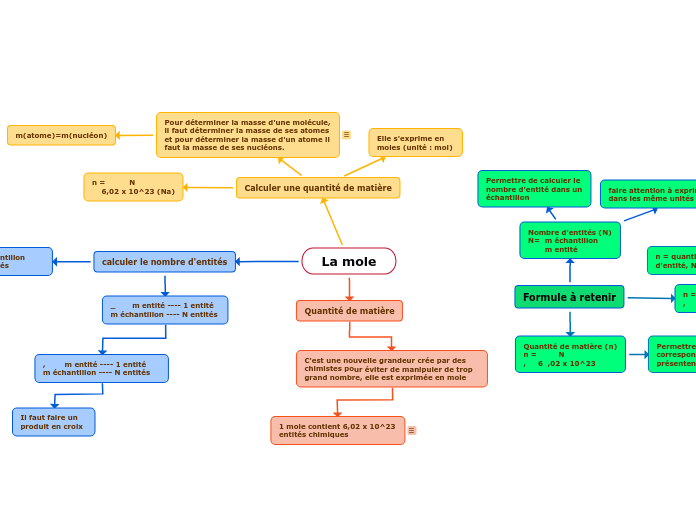
La mole
Les chimistes ont introduit la notion de mole pour simplifier la manipulation de grands nombres d'entités chimiques. Une mole est définie comme contenant 6,02 x 10^23 entités chimiques.
par Athéa Gonin-Bernard Il y a 3 années
1001

Plus de détails
Exemple :
m(carbone) = 12 x m(nucléon)
m(nucléon) = 1,67 x 10^-27
donc m(carbone) = 12 x 1,67 x 10^-27
= 2,00 x 10^-26 kg
= 2,00 x 10^-23 g
Exemple : Un vert contient 10 mole d'eau, alors elle contient 10 x 6,02 x 10^23 molécule d'eau
Il faut faire un produit en croix