QUÍMICA BÁSICA
ORBITALES ATÓMICOS
Configuración Electrónica
Distribución más estable (menr energía) y probable de los electrones entre los orbitales disponibles de un átomo.
Niveles Energéticos
s: de spín
m: magnético
l: secundario o azimutal
n: principal
¿Qué es un orbital?
Representación del espacio que ocupa un eletrón en un átomo
Mezclas
Heterogéneas
Mezclas en las que se observan sus componentes o fases, y están claramente formadas por varias sustancias.
Ej. Sal y grava
Homogéneas
Mezclas donde no se observan sus componentes o fases
Soluciones
SOLUTO + SOLVENTE
Sobresaturadas
No saturadas
Saturadas
¿Qué es una mezcla?
Es la unión de dos o más elementos o compuestos, en la que cada uno conserva sus propiedades; son de composición variable y se pueden separar por métodos físicos o mecánicos.
SUSTANCIAS
Moléculas
Partícula más pequeña de un compuesto que conserva sus propiedades
Compuestos
Unión de dos o más elemento
Elementos
Unión de átomos del mismo tipo
Puras
Formadas por un solo componente
TABLA PERIÓDICA
- Agrupa a los elementos con propiedades físicas y químicas similares.
- Los elementos se ordenan de acuerdo a su número atómico.
Propiedades Periódicas
Potencial de Ionización
Electronegatividad
Familias y Periodos
Regla del octeto
Electrones de valencia
Valencia
Perido
Filas
Grupo o Familia
Nos indican el número de electrones en el último nivel de energía de un elemento.
Columnas
Clasificación de los elementos
Metaloides
No Metales
Metales
ENLACES
Covalentes
Coordinado
No polar
Polar
Iónicos
¿Qué es un enlace?
ÁTOMO
Modelos atómicos
TAREA
Realizar una revisión sobre las teorías atómicas de Schrödinger
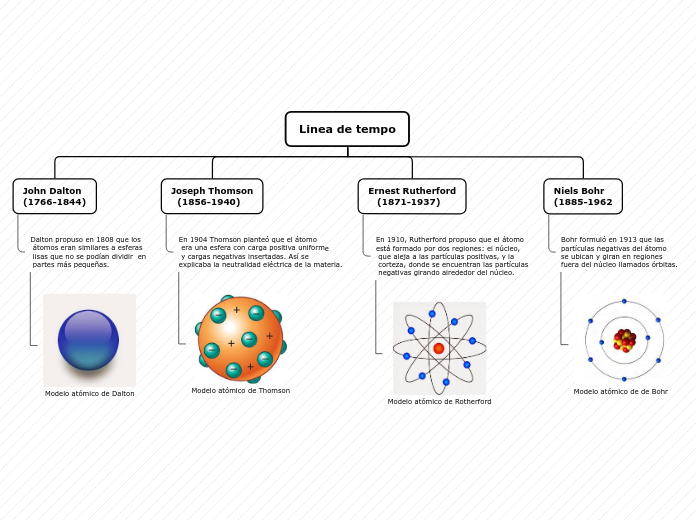
Bohr
Modelo de Bohr:
- Los electrones giran aldedor del núcleo en órbitas circulares
- Los electrones no ganan ni pierden energía si no cambian de nivel
- Cuando los electrones saltan de un orbital de menor energía a otro de mayor, absorben energía; cuando los electrones pasan de un nivel de mayor energía a otro de menor, desprenden energía.
Orbitales
Rutherford
1911: suponía que el átomo tenía un núcleo muy pequeño donde se concentra la carga positiva y casi toda la masa del átomo. Además, el núcleo está rodeado por electrones dispersos en un espacio vacío relativamente extenso.
Átomo con núcleo
J. J. Thomson
Modelo atómico: los rayos catódicos son partículas negativas (electrones) que se devían de sus trayectorias por campos eléctricos y magnéticos. El modelo muestra al átomo constituido por electrones que se mueven en una esfera de electricidad positiva uniforme donde se distribuyen una serie de capas concéntricas.
- Modelo del budín con pasas
Rayos catódicos = electrones
J. Dalton
Hipótesis (1808): el átomo es la partícula fundamental de la materia que tiene la capacidad de asociarse con otros átomos para formar moléculas.
- Los elementos se componen de partículas diminutas e indivisibles llamadas átomos
- Los átomos del mismo elemento son iguales en tamaño y masa
- Los átmos de elementos diferentes tienen masas y tamaños diferentes
- Los compuestos químicos se forman por la unión de de dos o más átomos de elementos diferentes
Átomo: partícula fundamental de la materia
Estructura atómica
Electrón
Subpartícula (-)
Neutrón
Subpartícula (+/-)
Protón
Subpartícula (+)
¿Qué es un átomo?
Un átomo es la partícula más pequeña en que un elemento puede ser dividido sin perder sus propiedades químicas.