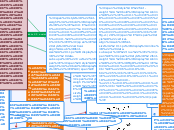
Химия
Химические реакции можно разделить на гетерогенные и гомогенные, в зависимости от фазового состояния реагентов. Гетерогенные реакции включают взаимодействие газа с жидкостью или твердым веществом, а гомогенные —
Megnyitás
aA+bB=cC+dD
V=k*[A]a+[B]b Газ+тв.вещ.во
Fe + 2HCl = FeCl2 + H2
↓ ↓ ↓ ↓
метал. связь ков. пол. ионная ков.непол Чтобы оценить энергозатраты на процесс без учета потерь тепла плавильным агрегатом необходимо верно рассчитать энтальпию(∆Н) Атом представляет собой сложную микросистему находящихся в движении и взаимодействующих друг с другом элементарных частиц. С помощью расчета энергии Гиббса для одной реакции при различных температурах определяют : чтобы узнать температуру начала самопроизвольной реакции уточняют нижнюю температурную границу для рассматриваемого восстановительного либо окислительного процесса температуру начала самопроизвольного протекания реакции Большое выделение энергии
Mg+1/2O2=MgO(оксид)
∆Н=-602,5
↓
∆Н=∑Нпр.-∑Нисх
(из закона Гесса) Образуется молодес. вещ
H2O Выпадает:
Осадок↓
или выделяется газ↑ Если Кр<1
←(влево) Если Кр>1
→(вправо) Константа равновесия К
aA+bB+cC+dD [прод]↑← [исх]↑→ Концентрация С P↓→большего объема V↑ Р↑→меньшего объема V↓ Давление в газах P Факторы влияния Химическое равновесие:
V→=V← ∆Н<0→экзотермическая Т↓ Температура Т ∆Н>0→эндотермическая Т↑ Природа Катализатор kat Гетерогенные реакции:
газ + жидкость
газ + твердое вещество
жидкость + твердое вещество. Гомогенные
реакции:
A+B+K→AB+K
2KOH+H2SO4→K2SO4+2H2O
гидроксид кислота соль оксид
↓ ↓ ↓ ↓
ОН кислотный средняя О
остаток Закон действующих масс Концентрация Факторы влияющие на V: Температура Уравнение Аррениуса Правило Вант-Гоффа Химическая кинетика(изучает V химических реакций) Химические реакции Химическое неравновесие
V→≠V← Гетерогенные Гомогенные Необратимые Обратимые
→
←