a Ernesto Rafael de Jes�s Torrez Alvarado 3 éve
300
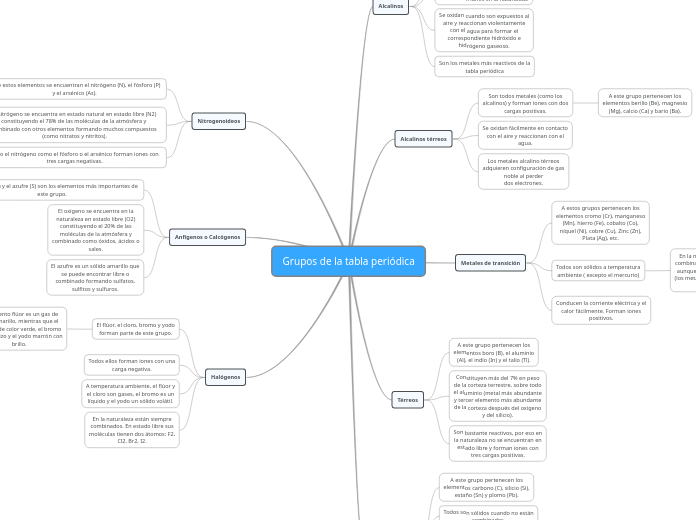
Grupos de la tabla periódica
Los grupos de la tabla periódica incluyen categorías como los nitrogenoideos, alcalinos, metales de transición y anfígenos. Los nitrogenoideos, que comprenden el nitrógeno, fósforo y arsénico, forman iones con tres cargas negativas y tienen diversas aplicaciones y formas alotrópicas.