da Ciriaco Sciaraffa mancano 5 anni
475
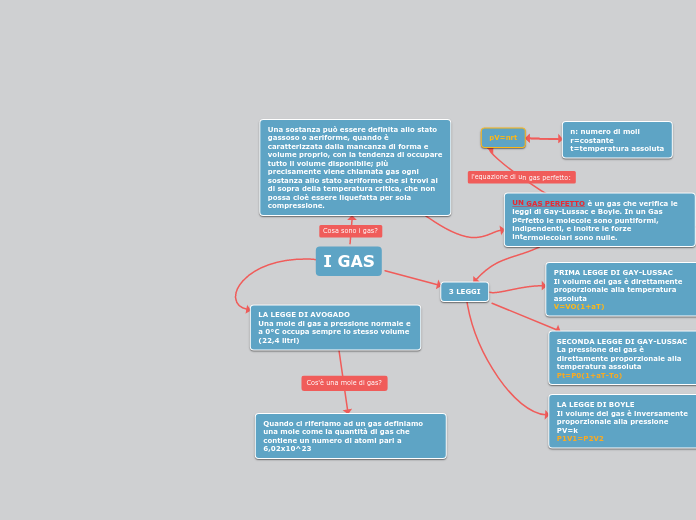
I GAS
La termodinamica studia le trasformazioni energetiche nei sistemi fisici. Nei gas, la pressione, il volume e la temperatura sono le variabili principali. La legge di Boyle afferma che il volume di un gas è inversamente proporzionale alla sua pressione, mentre le leggi di Gay-Lussac stabiliscono che la pressione e il volume di un gas sono direttamente proporzionali alla temperatura assoluta.