4. Salazar L, Guerrero M. Caracterización, clasificación y usos de las enzimas [Internet]. Scielo. 2021 [cited 29 June 2021]. Available from: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-03002020000400017
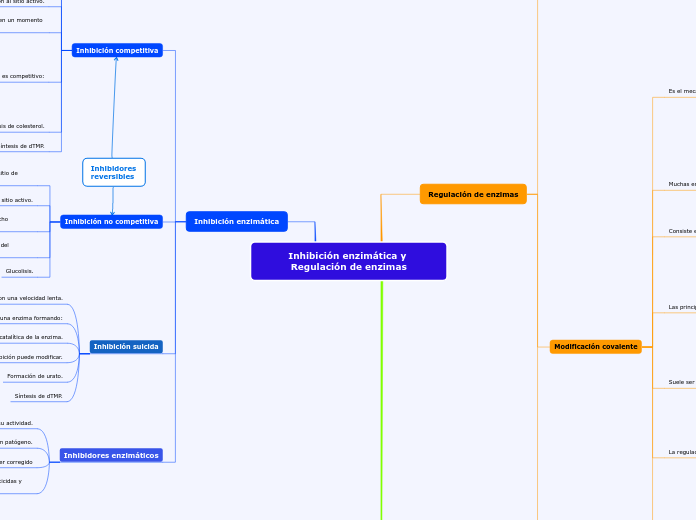
Inhibidores reversibles
Se une a una enzima diferente del sitio activo.
Inhibición enzimática y Regulación de enzimas
Inhibición enzimática
Inhibidores enzimáticos
Muchos medicamentos son usados, además de pesticidas y herbicidas
Un desequilibrio metabólico puede ser corregido
El bloqueo de una enzima puede matar un patógeno.
Moléculas que se unen a enzimas y disminuyen su actividad.
Inhibición suicida
Formación de urato.
Esta inhibición puede modificar.
Cualquier porción de una enzima.
Impide la actividad catalítica de la enzima.
Reacciona con una enzima formando:
Un enlace covalente.
Que no se puede dividir o separar con facilidad.
Se disocian de la enzima con una velocidad lenta.
Por lo tanto son irreversibles.
Inhibición no competitiva
Glucolisis.
El grado de inhibición depende de la concentración del inhibidor.
No llegara a su velocidad máxima, incluso en presencia de mucho sustrato.
El inhibidor no bloquea la unión del sustrato con el sitio activo.
Los inhibidores que se unen al sitio catalítico a cierta distancia del sitio de unión al sustrato son:
Inhibidores alostéricos.
Inhibición competitiva
Síntesis de dTMP.
Síntesis de colesterol.
Si un inhibidor es competitivo:
Cabe recalcar que si hay mucho sustrato será beneficioso.
Prioritariamente si hay suficiente sustrato.
Debido a que la enzima de cualquier forma puede alcanzar la velocidad máxima de reacción.
Bajara la velocidad de reacción cuando no hay mucho sustrato.
El inhibidor o bien el sustrato puede estar unido a la enzima en un momento dado.
Inhibidor compite con el sustrato por su unión al sitio activo.
Con altas concentraciones de sustrato el inhibidor se queda fuera.
El sustrato y el inhibidor no pueden unirse al mismo tiempo.
Bibliografías:
3. Ruiz N, Solís C. ALGUNAS PROPIEDADES CINÉTICAS [Internet]. Redalyc.org. 2021 [cited 29 June 2021]. Available from: https://www.redalyc.org/pdf/3719/371937618003.pdf
2. Zabala D, Martínez A. ACTIVIDAD INHIBITORIA SOBRE LA ENZIMA [Internet]. Scielo. 2021 [cited 29 June 2021]. Available from: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0121-40042008000200012
1. Ronner P. Netter bioquímica esencial. Barcelona-España; 2020.
Regulación de enzimas
Regulación Genética
Proceso de activación y desactivación de los genes.
asegura que los genes
modificación química
mediante
asociación con proteínas reguladoras.
se presenten en el momento adecuado
etapas tempranas
células asumen funciones especificas
Modificación covalente
Pueden ser
Irreversibles
grupos diferentes
un mismo grupo modificador
reversibles
múltiples
efectos muy variados
antagónicos
gliceraldehido-3-fosfato deshidrogenasa
carácter dominante
activadora
sinérgicos
únicas
La regulación covalente y la alostérica
La regulación covalente
tiene una ventaja que no tiene la alostérica
presenta el fenómeno de ampliación
No obstante
la regulación covalente
el cual no se produce en la regulación alostérica
representa un gasto energético
presentan la misma eficacia
Suele ser un fosfato
en el ciclo fosforilación-desfosforilación
esta asociado
nitrosilación
tirosil-proteína kinasa
seril-(treonil)-proteina Kinasa
Las principales modificaciones
que conducen a una modificación de la actividad enzimática.
activa <---> inativa
ADP-ribosilación
uridilación
destilación
Adenilación
deadenilación
Acetilación
desacetilación
Fosforilación
desfosforilación
Consiste en la adición o separación de
Por la acción de enzimas
Protein quinasa
un grupo funcional
Muchas enzimas reguladoras
esta controlada por la modificación covalente
constituye
a un nivel superior de información molecular.
a un nivel nuevo
Es el mecanismo
Incrementa la variedad de los precursores
forma selectiva
determina el lugar y el momento de su actividad
modifica sus interacciones con otras moléculas
aporta a propiedades nuevas
modula funciones y otras propiedades de las proteínas
el cual la unión por enlace covalente de un grupo químico a la enzima.
que produce una variacion
en la velocidad de reacción
provoca un cambio conformacional
Regulación alostérica
HEMOGLOBINA
No es enzima alostérica
Sin embargo
Tiene varios sitios activos
Se une al oxígeno
También en los demás sitios activos
Muestra cooperatividad
En el transporte de O2
Proteína que transporta oxígeno a la sangre
No cataliza una reacción
Cooperatividad
Sustrato sirve como activador
Aumenta la actividad de otro sitio activo
Se une al sitio activo
Enzimas alostéricas
Pripiedades únicas
papel crucial
Regulación del metabolismo
señalización celular
Contituidos
una o más subunidades
Cadena cuaternaria
Cademas polipeptídicas
Cambiar conformación
Modularor
Efector
Casos de regulación alostérica
Algunos: inhibición competitiva
Casi todos: Inhibición no competitiva
Forma de regulación
Lugar de unión
Sito alostérico.
Activador o inhibidor
Molécula reguladora