da Felipe Nicolás Aravena Rojas mancano 3 anni
323
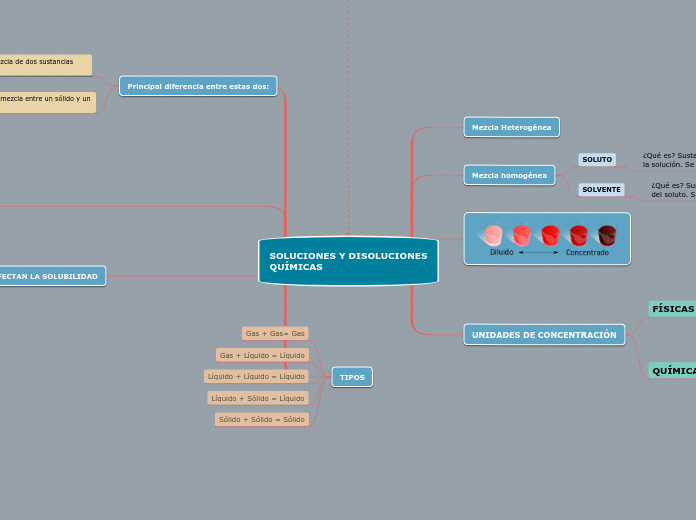
SOLUCIONES Y DISOLUCIONES QUÍMICAS
La solubilidad de los sólidos y gases en líquidos varía con la temperatura y la presión. Al aumentar la temperatura, la solubilidad de un sólido generalmente se incrementa, mientras que la de los gases disminuye.