によって MONSERRATH AZUL RAMIREZ HERNANDEZ 3年前.
148
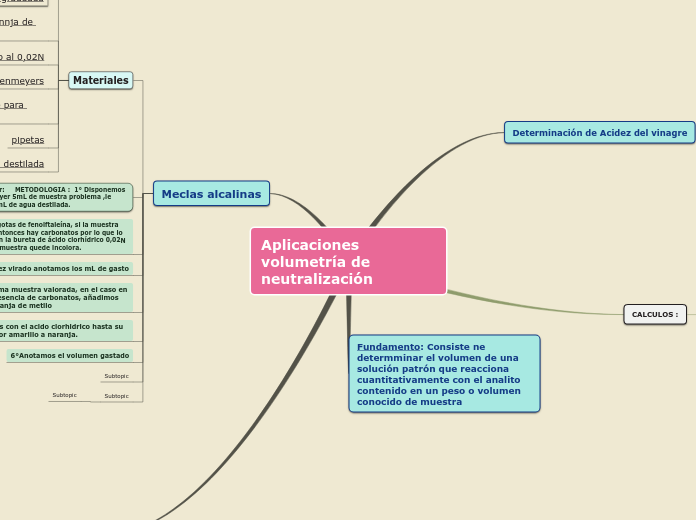
Aplicaciones volumetría de neutralización
La volumetría de neutralización es una técnica utilizada para determinar la cantidad de una sustancia en una muestra a través de una reacción química con una solución patrón. Un ejemplo común es la determinación de la acidez del vinagre, donde se mide un volumen específico de vinagre, se añade agua y un indicador, y luego se titula con una solución de hidróxido de sodio hasta observar un cambio de color.