by Valentina Battaglia Lagier 4 years ago
713
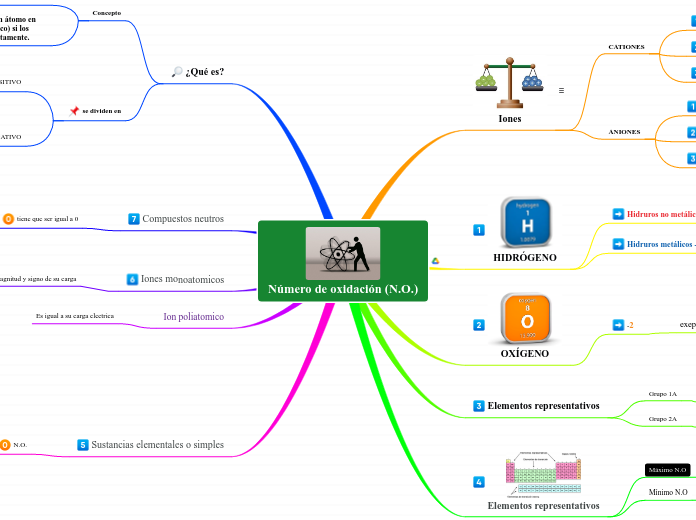
Número de oxidación (N.O.)
La información proporcionada se centra en los números de oxidación y su aplicación en diferentes contextos químicos. Se describe cómo determinar el número de oxidación para elementos representativos, tanto en sus estados mínimos como máximos, y se menciona que las sustancias elementales tienen números de oxidación específicos según su grupo en la tabla periódica.