door Hebertty Dantas 8 jaren geleden
1223
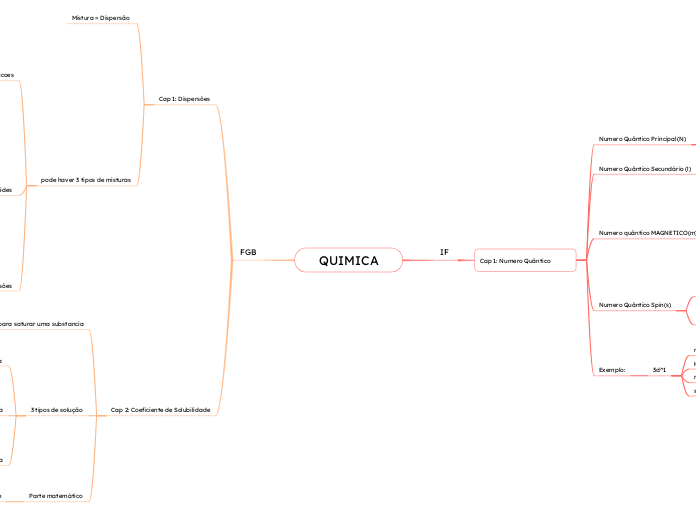
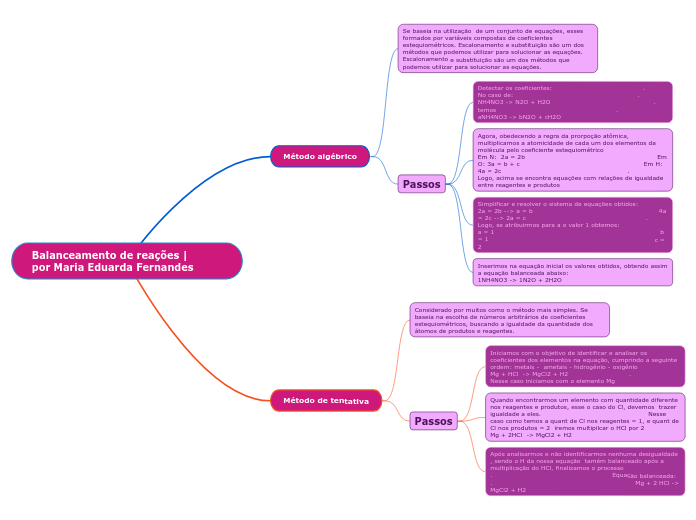
Balanceamentos
O processo de balanceamento de equações químicas envolve várias etapas para garantir que a lei da conservação da massa seja respeitada. Primeiramente, é essencial calcular a variação do Número de Oxidação (