door ANDREA CAROLINA MIRANDA LOPEZ 5 jaren geleden
238
Organigrama
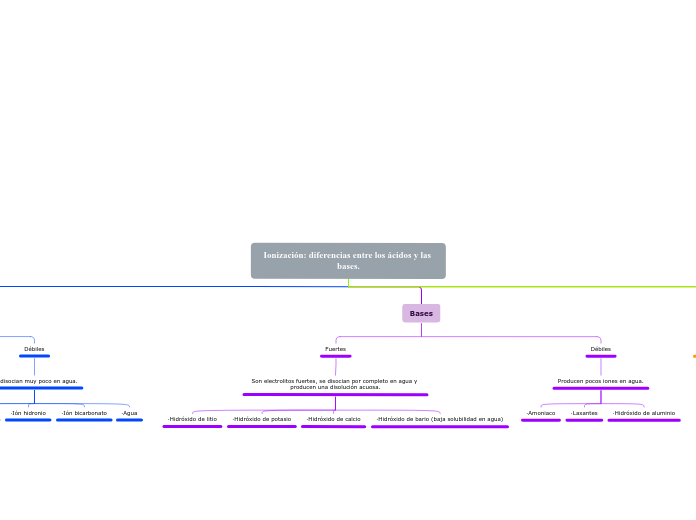
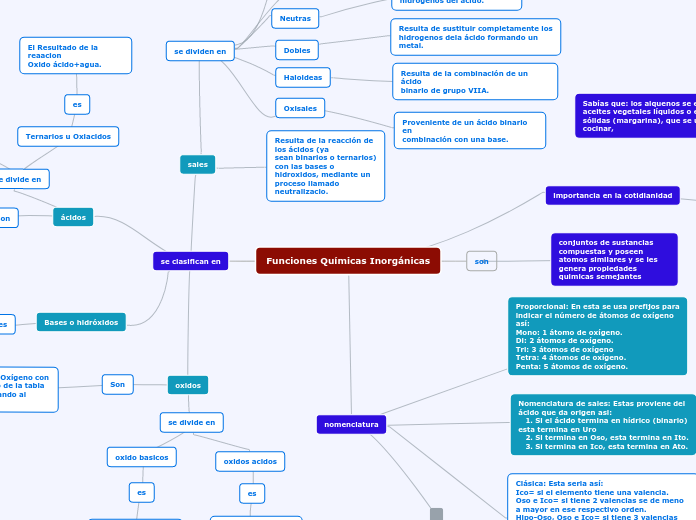
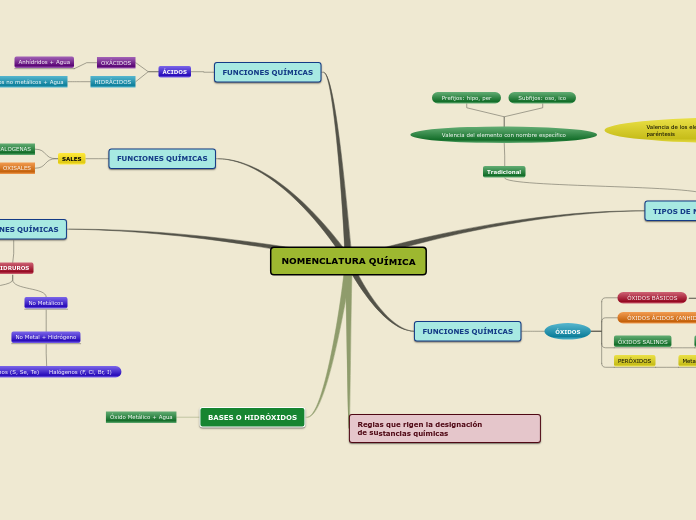
En el estudio de la química, la ionización y la disociación son dos procesos fundamentales que explican el comportamiento de ácidos y bases en soluciones acuosas. Los ácidos fuertes, como el sulfúrico y el yodhídrico, se caracterizan por su capacidad de disociarse por completo en agua, liberando una gran cantidad de iones hidrógeno, lo que los convierte en electrolitos fuertes.