door Arijan Vaiti 5 maanden geleden
93
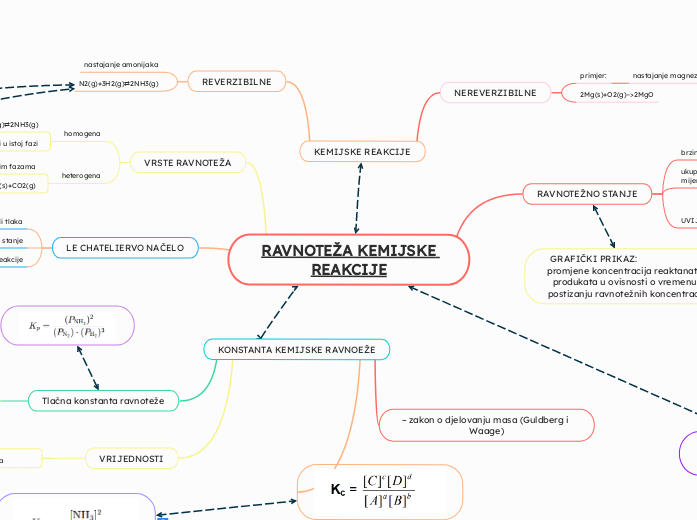
RAVNOTEŽA KEMIJSKE REAKCIJE
Chemické reakce mohou být nevratné nebo reverzibilní. Nevratné reakce, jako je tvorba oxidu hořečnatého, probíhají jednosměrně, zatímco reverzibilní reakce dosahují rovnovážného stavu, kde rychlosti přímé a zpětné reakce jsou stejné.