NIJE KEMIJSKA RAVNOTEŽA
NO2
Smanjenje
Udesno prema produktina
Ulijevo prema raktantima
O2
NO
Povećanje
Smanjenje
2NO(g) + O2(g) ⇄ 2NO2(g)
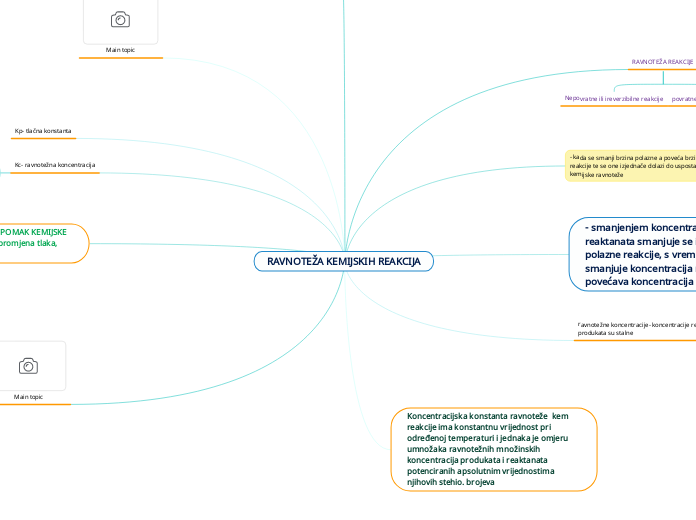
KONCENTRACIJA
TEMPRERATURA
Smanjenje temperature-
Povečanje temperature-
Ulijevo prema reaktantina
ΔrH ∘<0
Egzotermna reakcija
TLAK
Smanjenje tlaka-
Ulijevo prema reaktantima
Povečanje tlaka-
Udesno prema produktima
Utjecaj promjene temperature, tlaka i koncentracije na ravnotežno stanje kemijskog sustava
VRIJEDNOST ZA DAN PRIMJER
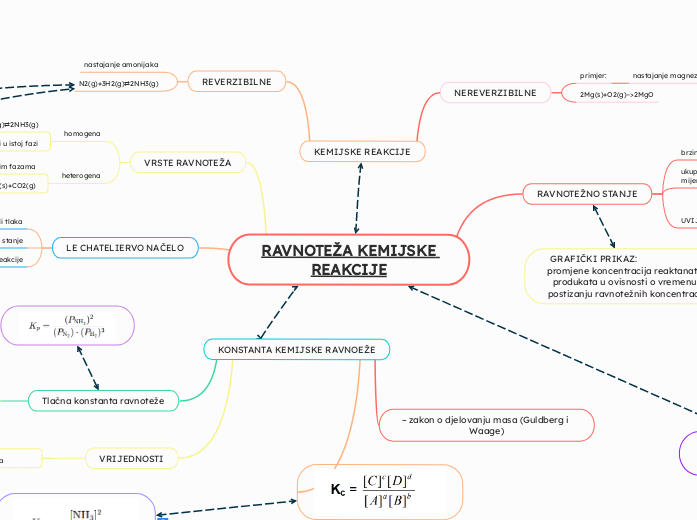
KONSTANTA KEMIJSKE RAVNOEŽE
VRIJEDNOSTI
K > 1 ⇒ ravnoteža pomaknuta na stranu produkata
K < 1 ⇒ ravnoteža pomaknuta na stranu reaktanata
Tlačna konstanta ravnoteže
– zakon o djelovanju masa (Guldberg i Waage)
GRAFIČKI PRIKAZ: promjene koncentracija reaktanata i produkata u ovisnosti o vremenu i postizanju ravnotežnih koncentracija
KEMIJSKE REAKCIJE
REVERZIBILNE
nastajanje amonijaka
NEREVERZIBILNE
2Mg(s)+O2(g)−>2MgO
primjer:
nastajanje magnezijevog oksida
RAVNOTEŽA KEMIJSKE REAKCIJE
LE CHATELIERVO NAČELO
promjena brzine napredne i povratne reakcije
sustav pokušava uspostaviti ravnotežno stanje
promjena konc. sudionika, temp. ili tlaka
VRSTE RAVNOTEŽA
heterogena
CaCO3(s)⇄CaO(s)+CO2(g)
tvari u različitim fazama
homogena
sve tvari u istoj fazi
N2(g)+3H2(g)⇄2NH3(g)
RAVNOTEŽNO STANJE
UVIJETI:
temperatura i tlak moraju biti stalni
sustav mora biti zatvoren
reakcija mora biti reverzibilna (povrativa)
ukupna koncentracija sudionika reakcije se ne mijenja
brzina napredne i povratne reakcije jednake