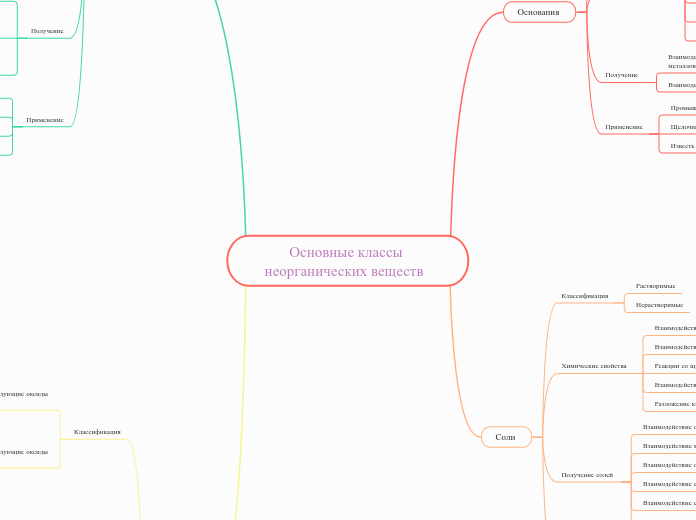
Основные классы неорганических веществ
Оксиды
Дезинфекция складских помещений
Производство стекла и бетона
Пищевая промышленность
Термическое разложение солей
CaCO3 → CaO + CO2
При горении или обжиге образуется оксид
2CH4 + 4O2 → 2CO2 + 4H2O
окисление металлов
2H2 + O2 → 2H2O
4Fe + 3O2 → 2Fe2O3
Основные оксиды
Взаимодействие с амфотерными оксидами
Взаимодействие с кислотными оксидами и кислотами
BaO + SO3 → BaSO4 сульфат бария,
Взаимодействие с водой
Li2O + H2O → 2LiOH гидроксид лития,
Кислотные оксиды
Взаимодействие с основными оксидами и щелочами
SO3 + Na2O → Na2SO4 (сульфат натрия).
Взаимодействие с водой
P2O5 + 3H2O2 → H3PO4 фосфорная кислота,
Солеобразующие оксиды
Кислотные оксиды
V2O5, P2O5, Mn2O7,
Амфотерные оксиды
Al2O3, Fe2O3, MnO2.
Основные оксиды
Li2O, K2O, Na2O, Ag2O, FeO, CrO, MgO.
Несолеобразующие оксиды
Кислоты
Взрывчатые вещества
В выпечке
Лакокрасочные изделия
Получение
Взаимодействие серной кислоты с твердыми солями
Взаимодействие некоторых простых веществ — металлов с водородом
Взаимодействие с солями
ВaCl2 + H2SO4 → BaSO4 + 2HCl (реакция обмена)
Взаимодействие с металлами
Mg+H2 SO4 +MgSO4 +H2 ( реакция замещения)
Взаимодействие с основаниями и основными оксидами
Cu(OH)2 + 2HBr → CuBr2 + 2H2O
Изменение окраски индикаторов
Лакмус: красный
Метилоранж : красный
Фенолфталеин: бесцветный
По содержанию атомов кислорода
Кислородсодержащие: HNO3, H2SO4, H3PO4 и др.
Бескислородные: HCl, HBr, HCN, H2S и др.
По основности
Четырехосновные: H4P2O7 и др.
Трехосновные: H3PO4, H3BO3, H3AsO4 и др.
Двухосновные: H2S, H2SO4, H2CO3 и др.
Одноосновные: HCl, HNO3, HCN и др.
Соли
В медицине
Использование в пищу
Удобрения
Получение солей
Взаимодействие солей с неметаллами
Взаимодействие солей со щелочами
Взаимодействие солей с кислотами
Взаимодействие основных оксидов с кислотами
Взаимодействие металлов с неметаллами
Взаимодействие основных оксидов с кислотными
Химические свойства
Разложение кислородсодержащих солей
CaCO3 = CaO + CO2
Взаимодействие с другими солями
CaCL2 + Na2CO3 = CaCO3 + 2NaCl
Реакции со щелочами
FeSO4 + 2NaOH = Na2SO4 + Fe (OH)2
Взаимодействие с кислотами
K2S + 2HCl = 2KCl +H2S
Взаимодействие с металлами
3CuCl2 + 2Al = 2AlCl3 + 3 Cu
Нерастворимые
Растворимые
Основания
Применение
Известь для побелки деревьев
Щелочные гели, для удаления жира
Промывание кухонной канализации
Получение
Взаимодействие нерастворимого основания и соли
Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
СaO + H2O = Ca(OH)2
Химические свойства
Разложение при нагревании
Cu(OH)2 = CuO + H2O
Взаимодействие с солями
KOH + CuSO4 = K2SO4 + Cu(OH)2
Взаимодействие с кислотными оксидами
NaOH + CO2 = Na2CO3 + H20
Взаимодействие с кислотами
NaOH + HCl = NaCl + H2O
Изменение окраски индикаторов
Фенолфталеин: розовый
Метилоранж : желтый
Лакмус: синий
Классификация
Нерастворимые : Mg(OH)2, Al(OH)3
Растворимые :NaOH, KOH щелочи