av Libanio Vieira 15 år siden
992
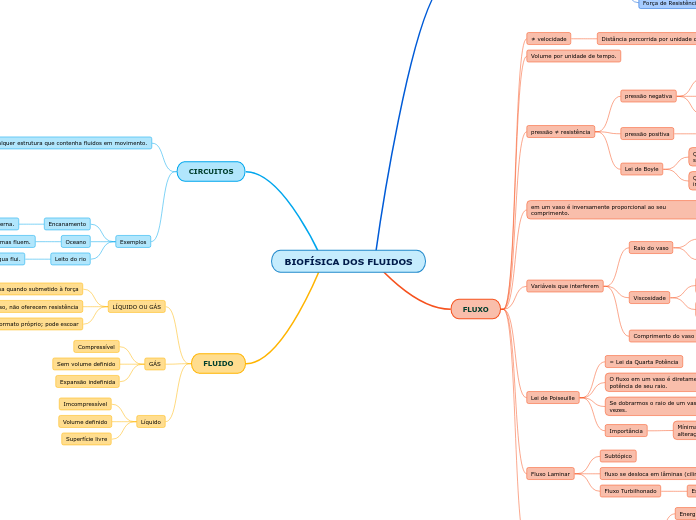
Gases
Os gases são caracterizados por não terem forma nem volume fixos, apresentando alta capacidade de expansão e compressibilidade, além de um elevado grau de liberdade molecular. As variáveis de estado que descrevem os gases incluem pressão (