struttura terziaria delle proteine
Proteine di MEMBRANA
sono le proteine che si trovano nello strato della membrana delle cellule( la parte più esterna, flessibile), essendo uno strato apolare, idrofobico non entra in contatto con l'acqua
la superficie della proteina che si trova in questo ambiente fortemente apolare è costernata da residui di AA idrofobici.
un esempio è la Glicoforina:
presente nella mmbrana dei glonuli rossi,
è capace di legarsi a composti che servono
a determinare il gruppo sanguigno.
la parte che attraversa la membrana presente 17 su 19 AA di tipo apolari, mentre il resto degli AA che si trovano sia nello spazio interno, sia fuori la membrana sono di tipo sia polare che apolare.
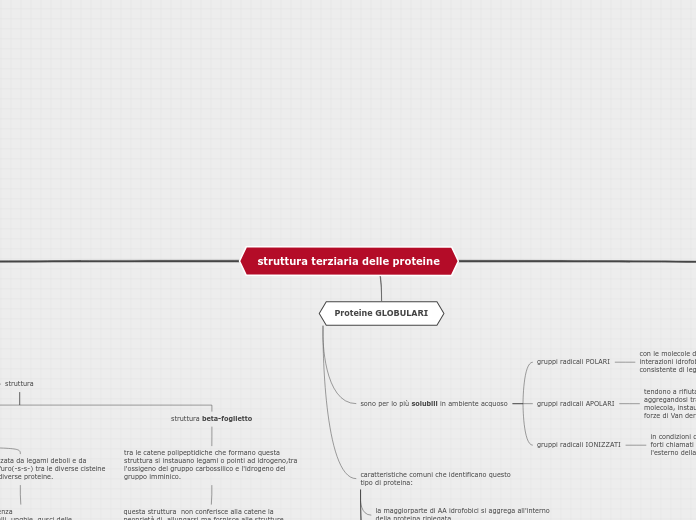
Proteine GLOBULARI
caratteristiche comuni che identificano questo
tipo di proteina:
le cisteine si legano attraverso la catena laterale per formare ponti disolfuro.
gli AA ionizzanti si trovano disposti a coppie; la catena laterale acida( carica negativamente e pH 7) è vicino a unabasica(carica positivamente a pH7).
la maggiorparte degli AA idrofobici si trovano sulla superficie esterna della proteina quando è a pH7.
alcuni AA sono ionizzanti, cioè carichi.
la maggiorparte di AA idrofobici si aggrega all'interno della proteina ripiegata.
sono per lo più solubili in ambiente acquoso
gruppi radicali IONIZZATI
in condizioni di pH7 formani legami estremamente forti chiamati ione-dipolo, che si spingono verso l'esterno della struttura proteica.
gruppi radicali APOLARI
tendono a rifiutare le molecole d'acqua, aggregandosi tra loro all'interno della stessa molecola, instaurando interazioni idrofobiche quali le forze di Van der Waals.
gruppi radicali POLARI
con le molecole d'acqua si stabiliscono
interazioni idrofobe, presentando un numero consistente di legami o ponti a idrogeno.
Proteine FIBROSE
struttura
struttura beta-foglietto
tra le catene polipeptidiche che formano questa struttura si instauano legami o pointi ad idrogeno,tra l'ossigeno del gruppo carbossilico e l'idrogeno del gruppo imminico.
questa struttura non conferisce alla catene la peoprietà di allungarsi ma fornisce alle strutture un'ampia elasticità e una notevole resistenza.
struttura dell' alfa-elica
=alfa-cheratina
la struttura è stabilizzata da legami deboli e da legami a ponte disolfuro(-s-s-) tra le diverse cisteine che compongono le diverse proteine.
ciò conferisce resistenza
( la troviamo in capelli, unghie, gusci delle tartarughe,...)
la cheratina ha struttura molto forte,
è organizzata su più livelli.
tre catene di alfa-elica si avvolgono tra loro per formare PROTOFIBRILLE.
le protofibrille si aggregano e formano le MACROFIBRILLE.
tra le macrofibrille si instaurano legami sia lateralmente che longitudinalmente; questo conferisce spessore, lunghezza e flessibilita, che le singole componenti che lo formano non possiedono.
Sono insolubili in acqua
a causa del numero consistente di gruppi R,
i quali sono idrofobici, degli amminoacidi che si trovano sull'alfa-elica