Metodología
Funcionalización de 3-pyrrolyl BODIPYs y su uso en la síntesis de derivados basados en 3-pyrrolyl BODIPY
Derivados y conjugados de 3-pyrrolyl BODIPY
Preparación de nuevas αaryl sustituida 3-pyrrolyl BODIPYs bajo condiciones de acoplamiento Pd (0)
Purificación en columna cromatográfica
Acoplamiento de α-bromo-3-pyrrolyl BODIPY con un ácido borónico apropiado en mezcla de THF/Tolueno/agua 1:1:1 en presencia de una cantidad catalitica de Pd(PPh_3)_4/Na_2CO_3 por 6-10 horas a 80°C
La pyrrolyl dipyrrin complejada con boro y el resto complejada con paladio se dispuso en dos planos con un angulo 41.9
preparación de mono bromo 3-pyrrolyl BODIPY con phenyl acetylene bajo acoplamiento Sonogashira
Intereses
Redox
Propiedades fotofísicas
octa-brominated 3-pyrrolyl
El NH del pyrrol se encuentra involucrado en un enlace de hidrogéno intramolecular fuerte y moderado con los iones fluoruro del grupo BF_2
Purificación por cromatografía en columna de gel de sílice
Tratamiento de 3-pyrrolyl BODIPY en exceso de bromo líquido en CH_2Cl_2 a temperatura ambiente
Serie de 3-pyrrolyl BODIPYs monofuncionalizados que contienen grupos funcionales tales como:
Trimetilsilacetileno
El grupo trimetilsilacetileno que contiene 3-pirrolyl BODIPY
Tratamiento del α-bromo 3-pyrrolyl BODIPY con trimetilsilacetileno en tolueno/trimetilamina a 80°C en presencia de catalizador Pd(PPh_3)_2Cl_2 y CuI por 3 horas
Nitro
Síntesis de α-nitro 3-pyrrolyl BODIPY
Purificación cromatográfica en columna de gel de sílice
Tratamiento de 3-pyrrolyl BODIPY con HNO_3 diluido en anhídrido acético durante 2 horas a 0°C
Ciano
Síntesis de α-cyano 3-pyrrolyl BODIPY
Tratamiento con I_2/aq NH_3 por 3 horas a temperatura ambiente
Calentamiento a 50°C
Tratamiento de 3-pyrrolyl BODIPY con reactivo de Vilsmeier en 1,2-dicloroetano a temperatura ambiente durante 2 horas
Formilo
Síntesis de α-formyl 3-pyrrolyl BODIPY
Tratamiento de 3-pyrrolyl BODIPY con Vilsmeier reagent en 1,2-dicloroetano a temperatura ambiente durante 2 horas.
Bromo
Sintesis del mono-brominated meso-phenyl 3-pyrrolyl BODIPY
Purificación en columna cromatográfica de gel de sílice
Tratamiento de 3-pyrrolyl BODiPY con 1 equivalente de N-bromosuccinimide en CHCl_3 a 0°C por 30 minutos
La coordinación aniónica de α-pyrrolyl dipyrrins
Quesada
Propiedades de unión de compuestos basados en obatoclax tanto en estado sólido como en solución
Excelente capacidad de coordinación hacia MeSO_3^-, Cl^- y HCO_3^-
Estudio del efecto de modificación del anillo C de prdigiosin en el transporte de C- a través de la membrana celular
Sessler
Capacidad de unión y transporte del ion cloruro a las α-pyrrolyl dipyrrins sustituidas con éster
Propiedades
Protección anti Cl^-/HCO_3^- y Cl^-/NO_3^-
Facilitó el simbolismo del H^+/Cl^- a través de la membrana celular
Poseen un bolsillo de unión (unión de aniones por interacciones electrostáticas.
El mejor prodigiosins de molécula pequeña que se conoce es aniónfoes con la capacidad de transporte aniónico impresionante
Capacidad de controlar la eficiencia de transporte de aniones transmembrana
Impoetante en el desarrollo de agentes terapéuticos o sensores de aniones
Excelentes catalizadores para la unión y transporte de aniones a través de membranas lipídicas
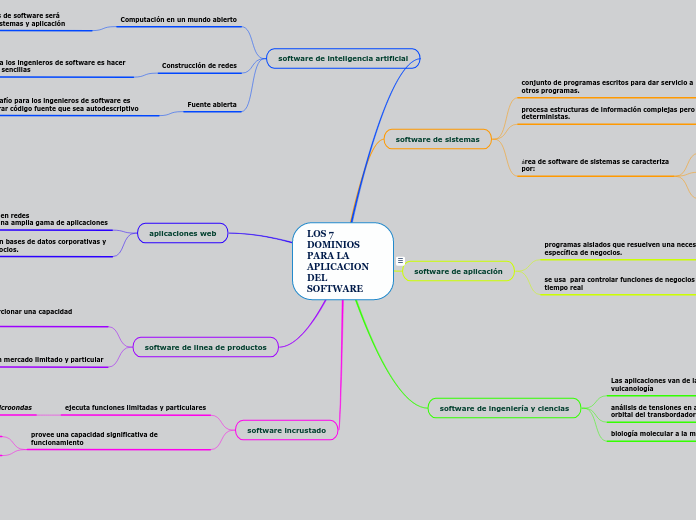
BF_2-complejos de pyrrolyl dipyrrins (pyrrolyl BODIPYs)
Propiedades generales de 3-pyrrolyl BODIPYs
Propiedades espectrales y electroquímicas
Voltamograma cíclico
Espectros de fluorescencia
Absorción
Síntesis de 3-pyrrolyl BODIPYs
Hao, Jiao
Síntesis del halogeno sustituido 3-pyrrolyl BODIPYs
Reacción de tetra/hexa halogenated BODIPYs con pyrrole bajo condiciones de reacción suaves
Estructuras cristalinas
El pyrrole tiende a estar en el plano con el núcleo BODIPY
Desviación de pyrrole dependiendo de el tipo de meso-sustituyente.
3-Pyrrolyl/3-indolyl isoindole BODIPYs
Reacción de los derivados de 5-halogenated-2-formyl pyrrole con exceso de pyrrole en presencia de POCl_3 catalizado con diclorometano
Pyrrolyl BODIPYs a partir de pyrrole y acyl chloride
En la reacción se generó una sustitución oxidativa nucleofílica con pyrrole para formar pyrrolyl dipyrrin con complejos de BF_3*Et_2O
Purificación en cromatografía de columna
Complejación con BF_3OEt_2
El acyl chloride se trató con 10 equivalentes de pyrrole en 1,2-dicloroetano en presencia de oxígeno
Sustitución oxidativa nucleofílica de BODIPYs
Purificación por medio de una columna cromatográfica
Tratamiento de diferentes BODIPYs meso-aryl con pyrrole en presencia de oxígeno a reflujo
2011
Ravikanth
Sintesis de 3-pyrrolyl aryl BODIPYs fluoresente
Formación de complejos BF_3*Et_2O
Tratamiento con pyrrole
El meso-libre dipyrromethane fue oxidado con DDQ
Sintesis de complejos de BF_2 de prodigiosin tipo oligopyrroles
Separación del meso-aryl BODIPY y el 3-pyrrolyl meso-aryl BODIPY por medio de cromatografía en columna
Tratamiento con Et_2 seguido de BF_3OEt_2 a temperatura ambiente durante 30 minutos
Tratamiento con 3 equivalentes pyrrole a temperatura ambiente durante 15 minutos
Oxidación con 2.5 equivalentes de DDQ
Compañia Invitrogen
Síntesis de derivados de prodigiosin
Patente EEUU
Complejación con BF_3*OEt_2
Neutralización con Et_3N
Condensación catalizada por POCl_3 de pyrrole aldehyde con bipyrrole
Preparación
Método 4
Reacción con BF_2*OEt_2
Generación del ligando pyrrolyl dipyrrin in situ
Método 3
La reactividad de 1,9 dipyrrin y en las posiciones 3,5 el complejo BF_2 (BODIPY) hacia la sustitución/adición nucleofílica
Método 2
Formación del complejo por medio de BF_3 con OEt_2
Preparación in situ del ligando pyrrolyl bipyrrin al reaccionar bipyrrole con pyrrole bajo POCl_3
Método 1
Preparar los complejos de BF_2
Reacción de BF_3 con OEt_2
Empleando directamente las pyrrolyl dipyrrins como ligando
Usos
Marcador fluorescente en estudios biológicos
Complejos metálicos de α-pyrrolyl dipyrrin
Tratamiento de la pyrrolyl dipyrring
con Cu (OAc)_2 para la formación de un complejo cuadrado plano
los tres N del pyrrolyl y el oxígeno del carbonilo del éster en posición alpha se coordinaron al centro métalico Cu para formar la estructura cuadrada plana
con Zn(OAc)_2 para la formación de un complejo tetraédrico.
Estructura cristalina
Unión a dos átomos de N de dos fracciones de dipyrring para la formación de la estructura tetraédrica
Electrometría
Retira el pyrrolyl dipyrrin como un grupo fenilo esperando que aumente la acidez de los protones N-H y facilitar la desprotonación para coordinar con el metal, además de la esperada participación para coordinar del oxígeno.
Uso de pyrrolyl dipyrrins con un anillo arilo en posición meso y la funcionalidad de un éster en la posición polarizada horizontal del anillo C
Permiten la formación de complejos de Zn y Cu más estables
Síntesis de los ligandos α-pyrrolyl dipyrrin
Descomposición de complejos BF_2 de α-pyrrolyl dipyrrins
Desenmascarado de 3-pyrrolyl BODIPY
Derivados de Obatoclax similares a la prodigiosin
Formación de complejos metálicos con Zn(II) y Sn (IV)
Síntesis de β-benzoylester pyrrolyl dipyrrins
Capacidad de coordinar con:
El β-benzoylester pyrrolyl dipyrrins como ligando tridentado para la formación de complejos pentacoordinados
Zn (II)
Co (II)
Formación de un complejo tetraédrico con ligandos bidentados de β-benzoylester pyrrolyl dipyrrins
Evaluación in vitro usando la cepa plasmodium falciparum
Actividad antimalaria
Pyrrolyl dipyrrins funcionalizada con éster
Sal de ácido clorhídrico y prodigiosin funcionalizada con amida
Evaluación anticancerígena (inhibición del crecimiento de las células cancerígenas, por consiguiente es un compuesto citotóxico.
Amidación (46% de rendimiento)
Tratamiento con Zn(OAc)_2 en presencia de una base
Formación de geometría tetraedrica
Pyrrolyl dipyrrins funcionalizada con amida
Preparada con grupos NH ácido
Prodigiosin análogo portador del grupo amida
Reducida participación en la coordinación con los iones metálicos
Se estudió su actividad anticancerígena
dialkyl/diaryl pyrrolyl dipyrrinato
Reacción entre pyrrolyl dipyrrins con las respectivas sales de hidrocloruro con dibutyltin/dipheny oxide en metanol a temperatura de reflujo.
UV-Vis
Sn (IV)
560-605 nm
Sn (estaño)
Coordinación con tres N pyrrole de pyrrolyl dipyrrin y dos butilo o grupos fenilo para formar una bipiramide trigonal
Estructura pentacoordinada, donde el átomo coordinado esta distorsionado en la geometría bipolar bipiramidal
2003
Manderville
Complejos de Zn y Cu de prodigiosin (complejos tetraédricos)
Cobre (Cu)
Tratamiento con CuCl_2*H_2O en presencia de una base en alcohol butílico terciario caliente
Cu (II): Realizó unión a los tres N donantes y axiales para dar lugar a una estructura cuadrada plana
Cu (III): Un anillo del pyrrole se oxidó y se añadió un grupo OH al anillo C para generar un C de hidridación sp^3 reordenandose los enlaces para crear un doble enlace entre N1 y C4
Zinc (Zn)
Tratamiento con ZnCl_2*H_2O en presencia de una base en alcohol tert-butílico caliente
RMN
Blindaje del núcleo aromático del resto de la prodigiosin unido al Zn
Rayos X
Se coordinaron los N del bipyrrin
Importancia
Química de coordinación
Los N de dipyrrin prefieren coordinarse mientras que el N del pyrrolyl se inclinan por la descoordinación
Aplicaciones biológicas
Uso
Actúan como ligando tridentado dianiónico por sus tres átomos de N
Síntesis de un tipo de prodigiosin con ligandos de α-pyrrolyl dipyrrin
Xie
Sintetizar pentafluorophenyl sustituido a un purrolyl dipyrrin altamente electrorreceptor
Reacción con pyrrole en presencia de ácido
Reducción de un producto mono-keto
Hao
Uso de isoindoles para producir pyrrolyl dipyrrins
Exceso de pyrrole catalizado con POCl_3
Síntesis sencilla con una olla promovida por POCl_3 de pyrrolyl dipyrrins
Condensación de derivados de 5-halogenated-2-formylpyrrole con exceso de pyrrole en presencia de POCl_3, en diclorometano, temperatura ambiente bajo atmósfera de argón.
Tomat
Síntesis de pyrrolyl dipyrrin (éster alquílico en posición α del anillo C)
Acoplamiento con ácido pirrol-2-borónico protegido con N-Boc en condiciones de Suzuki
Oxidación con DDQ
Bromación con NBS
Condensación del pyrrole mono-ol con pyrrole catalizado bajo condiciones ácidas por AcOH/Ac_2O
Reducción del 2,5-di sustituido pyrrole con borohídruro de sodio
Thompson
Síntesis eficiente para α-pyrrolyl dipyrrin funcionalizadas en el anillo C
Acoplamiento Susuki con ácido pirrol-borónico protegido con dipyrronones
Tratamiento de dipirrononas con POBr_3
Condensación con 4-metoxi-3-porrolina-2-ona y proporcionar las dipirrononas
Introducción del bromo en lugar del triflate
D'Alessio y Rossi
Funcionalización del pyrrole adjunto (anillo A)
tratamiento de α-pyrrolyl dipyrrin con anhídrido acético en presencia de AlCl_3
prodigiosin scaffolds (α-pyrrolyl Dipyrrin)
Acoplamiento con cruzado del triftalato con ácido-pirrol-2-borónico protegido con N-Boc catalizado por Pd (0)
Tratamiento con anhídro trifluorometanosulfónico (TF_2O)
Condensación con lactama conjugada en DMSO catalizado por bases
Formilación en condiciones de Vilsmeier-Haack
α-triflate substituted dipyrrin sustituido de dypyrrin
1989
Wasserman y Lombardo
Usos del bis(pyrrole) aldehyde
Preparación de un tipo de prodigiosin tripyrrole scaffolds
Purificación cromatográfica en columna
Papeles de pirrol sustituidos en condiciones ácidas
Síntesis del bis(pyrrole) aldehyde)
Reacción de bromoenaamine con ácido borónico pirrol protegido con N-Boc, bajo las condiciones: Susuki-Miyaura
Conversión de lactam en bromoenaamine, tratamiento con Vilsmeier-Haack (PORBr_3/Et_2NCHO.
Síntesis corta del bis(pyrrole) aldehyde
Metodología singlete-oxígeno
Reducción McFayden-Stevens
Sustitución de un pyrrole en CH2_Cl_2 a oxígeno singlete, en baja temperatura, con pyrrole en exceso
Síntesis del bis(pyrrole) aldehyde
Reducción McFayden-Stevens con 98% hidrazina
Metilación y desprotección del bis(pyrrole) éster
Condensación con bencilamina en ácido acético glacial a 60°C
Oxidación con nitrosoanilina en NaOH etanólico
Deshidratación con HCl gaseoso en CH_3Cl a -5°C
condensación del acetilacetonato en THF