av David Martin Ruiz Ruiz 1 år siden
159
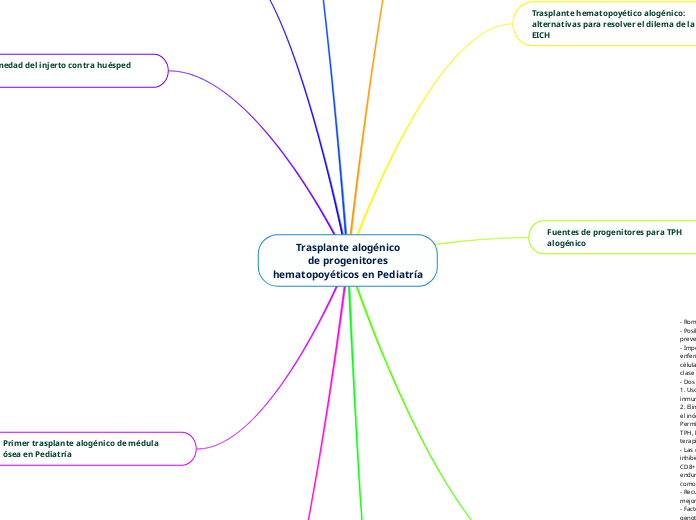
Trasplante alogénico de progenitores hematopoyéticos en Pediatría
El trasplante alogénico de progenitores hematopoyéticos (TPH) en pediatría utiliza diversas fuentes de progenitores como la sangre periférica movilizada, la médula ósea y el cordón umbilical.