por mily de niz 6 anos atrás
1218
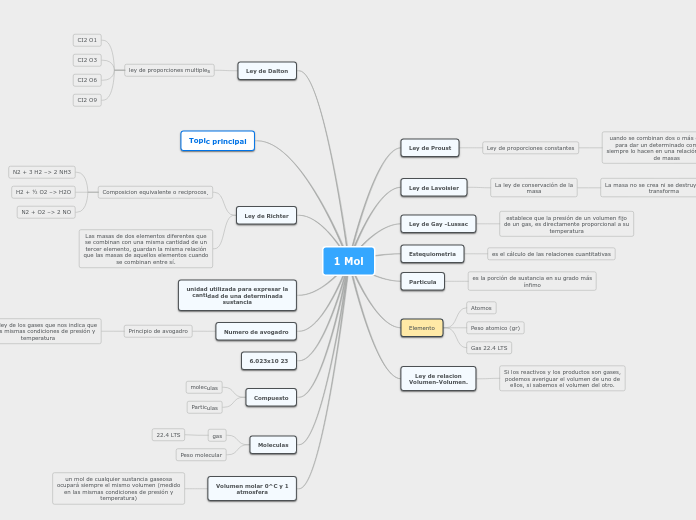
1 Mol
La química es una ciencia que estudia la composición, estructura y propiedades de la materia, así como las reacciones que la transforman. Una de las unidades fundamentales en química es el mol, utilizado para expresar la cantidad de una sustancia.