HISTORIA
Rutherford, Bohr: Propuso un modelo planetario donde el núcleo es el sol y los electrones son los planetas
Thomson: Se da cuenta que el átomo tiene cargas
Dalton: Genero el primer modelo atómico
Demócrito: La parte mas pequeña y fundamental de la materia
Materia
Mezclas
Combinación de sustancias que conservan sus características, No teniendo características propias, medios físicos de separación, su composición es variable.
Heterogénea: Se ven las fases
Homogénea: Parece una sola fase
Sustancias puras
Compuestos: 2 o mas elementos que forman enlaces estables
Elementos: Sustancia compuesta por los mismos atomos
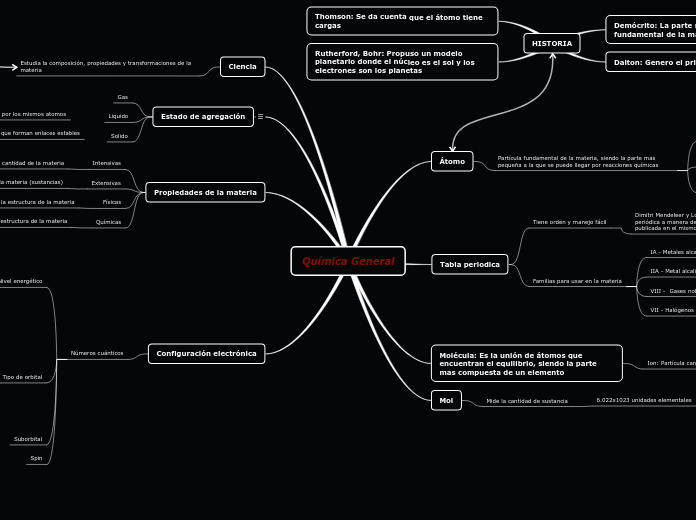
Química General
Configuración electrónica
Números cuánticos
Spin
Suborbital
Tipo de orbital
g - 4
f - 3
d - 2
p - 1
s - 0
Nivel energético
f - 7
d - 5
P - 3
s - 1
Propiedades de la materia
Químicas
Si modifican la estructura de la materia
Físicas
No modifican la estructura de la materia
Extensivas
No depende de la cantidad de la materia (sustancias)
Intensivas
No depende de la cantidad de la cantidad de la materia
Estado de agregación
Solido a gas: Sublimación
Gas a solido: Sublimación inversa
Gas a liquido: Condensación
Liquido a solido: Solidificación
Solido a liquido: Fusión
Liquido a gas: Evaporación
Solido
Liquido
Gas
Ciencia
Estudia la composición, propiedades y transformaciones de la materia
Mol
Mide la cantidad de sustancia
6.022x1023 unidades elementales
Molécula: Es la unión de átomos que encuentran el equilibrio, siendo la parte mas compuesta de un elemento
Ion: Partícula cargada
Anión: -
Catión: +
Tabla periodica
Familias para usar en la materia
VII - Halógenos
VIII - Gases nobles
IIA - Metal alcalino terneo
IA - Metales alcalinos
Tiene orden y manejo fácil
Dimitri Mendeleer y Lothor Meyer, acomodaron la tabla periódica a manera de menor a mayor masa atómica siendo publicada en el mismo ano, Mendeleer se llevo todo el crédito
Átomo
Partícula fundamental de la materia, siendo la parte mas pequeña a la que se puede llegar por reacciones químicas
Neutrón: Es de carga 0 (neutra), se posiciona en el nucleo y tiene masa
Electrón: Es de carga -, se posiciona en los orbitales y no tiene masa
Protón: Es de carga +, se posiciona en el nucleo, y tiene masa