Tabla Periódica
Grupos
7A
Los Óxidos de(F, Cl, Br, I)
Óxidos ácidos
ácidos muy fuertes al reaccionar con agua
HCl es mas fuerte que el HF
el HF es más débil que el HCl porque la fuerte atracción en el enlace H-F hace que sea más difícil para el HF disociarse completamente en agua, mientras que el HCl se disocia con mayor facilidad debido a la naturaleza más débil de su enlace.
I
Oxidarse y reducirse(Moderadamente se reduce)
Br
Oxidarse y reducirse(Mayormente se reduce)
Cl
oxidarse y reducirse(Mayormente se reduce)
F
Se reduce/Oxida a todos los elementos
-1
6A
Te
Oxidos del Te
Tienden Óxidos Ácidos
Óxidos del Se
Óxidos del S
Con agua forman ácidos
+ No metal
Óxidos Ácidos
+ Metal
Polonio(Metálico)
Oxidarse
Te(Metaloide)
Se
S
O
Tienda a oxidarse(Poco comun)
Tiende a Reducirse(Muy comun)
-2(O), -2,+4,+6(S, Se, Te).
5A
Óxidos del Bi
Basico
Óxidos de As y Sb
Anforteros
Óxidos de N Y P
Ácidos
Bi(Metal)
Sb(Metaloides)
As(Metaloides)
P(No metal)
N(No metal)
Tiende a Oxidarse como a reducirse
+5, +3
4A
Estaño y Plomo
Óxidos básicos
Silicio y Germanio
Óxidos anfóteros
Carbono
Óxidos Acidos
Estaño y Plomo(Metales)
Tienden a oxidarse
Silicio y Germanio(Metaloides)
una tendencia a oxidarse a su estado de oxidación más alto (+4), especialmente cuando reaccionan con oxígeno
Carbono(No metal)
Versatil
tiene un comportamiento redox versátil, participando tanto en reacciones de oxidación como en reacciones de reducción. Dependiendo del estado de oxidación y el compuesto con el que reaccione, el carbono puede ganar o perder electrones.
+4, +2(Pb)
El estado +4 es más estable que el estado +2 en el estaño porque el efecto del par inerte no es lo suficientemente fuerte para estabilizar los electrones 5s como sucede en el plomo.
3A
Ga, In, Tl
tendencia a actuar como ácidos de Lewis en sus compuestos
Aluminio
Boro
Anfotero
Ga, In, Tl(Metales)
Tienden a Oxidarse
Aluminio(Metal con carácter intermedio)
Tiende a oxidarse
porque su primer estado de oxidación es +3, lo que significa que puede fácilmente perder electrones. Sin embargo, a diferencia de otros metales que pueden corroerse rápidamente, el aluminio forma una capa de óxido protectora
Boro(Metaloide)
Tiende a oxidarse y una vez oxidado le cuesta reducirse
+3 +1(In y Tl)
2A
Los demás óxidos de los demás tienen carácter básico
BeO Es anfótero como el aluminio
Tienen propiedades reductoras y son menos reactivos que los del grupo 1.
+2
1A
Acido - Base
Tienden a formar bases fuertes al reaccionar con agua
Redox
Potenciales de Reducción negativos(Tienden a oxidarse)
Estado de Oxidación
+1
Reacción violenta con agua
La reacción de los metales alcalinos con agua se vuelve más violenta a medida que descendemos en el grupo porque el electrón de valencia es más fácil de perder, lo que aumenta la rapidez y la exotermicidad de la reacción. El calor liberado y la inflamación del hidrógeno gaseoso hacen que las reacciones sean progresivamente más espectaculares y peligrosas.
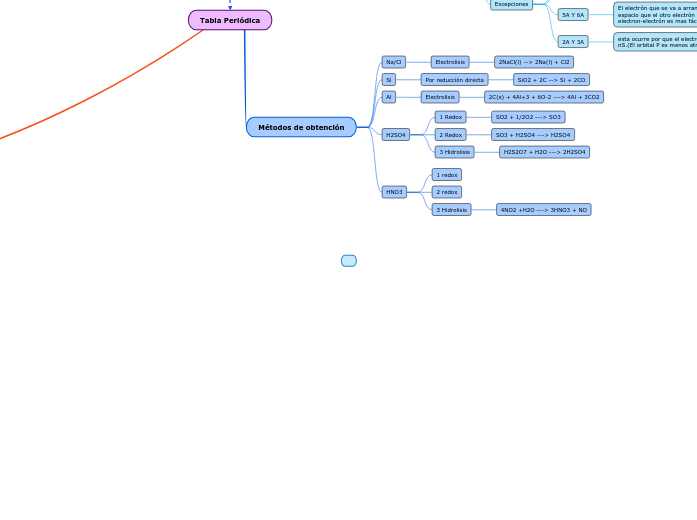
Métodos de obtención
HNO3
4NO2 +H2O ---> 3HNO3 + NO
2 redox
1 redox
H2SO4
3 Hidrolisis
H2S2O7 + H2O ---> 2H2SO4
2 Redox
SO3 + H2SO4 ---> H2SO4
1 Redox
SO2 + 1/2O2 ---> SO3
Al
2C(s) + 4Al+3 + 6O-2 ---> 4Al + 3CO2
Si
Por reducción directa
SiO2 + 2C --> Si + 2CO
Na/Cl
Electrolisis
2NaCl(l) --> 2Na(l) + Cl2
Misma explicacion
Entonces
dependen de los mismos factores fundamentales: la atracción entre los electrones y el núcleo, el tamaño atómico
Crecen juntas
Propiedades Periodicas
Principio de sigularidad
La indisponibilidad de orbitales d
Su intensa habilidad para formar enlaces Pi
Pequeños tamaño a respecto de los demás del grupo
Efecto del par inerte
Los electrones 4s 5s y 6s reciben una mayor carga nuclear efectiva de lo esperado y por ellos son mas difíciles de arrancar los electrones en esos orbitales
Es la tendencia de un átomo a atraer electrones compartidos en un enlace químico.
una medida de la fuerza neta con la que el núcleo de un átomo atrae a un electrón de la capa externa
Efecto diagonal
B - Si
El boro y el silicio son metaloides que forman compuestos covalentes y tienen propiedades de semiconductores. Ambos forman óxidos con oxígeno y reaccionan con los halógenos para formar compuestos covalentes.
Be - Al
Los compuestos del berilio son covalentes y parecidos al los del aluminio
Li - Mg
Sus sales están muy hidratadas a diferencia de las sales del sodio
Iones pequeños que muy polarizantes que producen interacciones mas fuerte con el agua.
Energía de Ionización
Excepciones
2A Y 3A
esta ocurre por que el electrón que se arranca es nP y no uno nS.(El orbital P es menos atraído por el núcleo)
5A Y 6A
El electrón que se va a arrancar ocupa el mismo volumen de espacio que el otro electrón en ese orbital y por la repulsión electron-electrón es mas fácil de arrancar.
Nitrógeno mayor energía que el Oxigeno
Berilio tiene mayor energía que el Boro
El electrón que se ioniza en el boro proviene de un orbital 2P que es mas energético y menos atraído por el núcleo que uno 2S
Es la energía necesaria para remover un electrón de un átomo en estado gaseoso.
Exepciones
Entre el 2do y 3er periodo de la tabla
Los del 2do son elementos mucho mas pequeños que los del periodo 3. Se hace mucho mas difícil que estos elementos mas pequeños acepten un electros debido a mayores repulsiones electron-electron
4A es mayor que la del 5A
En el grupo A5 se hace mas difícil aceptar el electrón por la teoría de repulsión de electrones.
1A es mayor que la del 2A
Se explica por que el electrón entrante ocupa un orbital nP que es de mayor energía que el nS que ocupara el electrón entrante del 1A. Consecuencia menor energía será liberada en el 2A.
La afinidad electrónica (AE) se expresa en números negativos en muchos casos porque representa la energía liberada cuando un átomo neutro en estado gaseoso captura un electrón. Un valor negativo indica que el proceso es exotérmico, es decir, el sistema libera energía
Es la energía liberada o absorbida cuando un átomo neutro en estado gaseoso captura un electrón.
Radio Atómico
el tamaño de los átomos, ya que a mayor radio, más grandes o voluminosos son
Relación entre propiedades
Carga nuclear efectiva
todas estas propiedades aumentan con un
𝑍ef más alto porque un núcleo más efectivo atrae más fuertemente a los electrones.
Energía de ionización
Afinidad electronica
Electronegatividad
Radio atomico
Un átomo más pequeño permite que el núcleo ejerza una mayor fuerza sobre los electrones.