por Sofi Arenales 4 anos atrás
1259
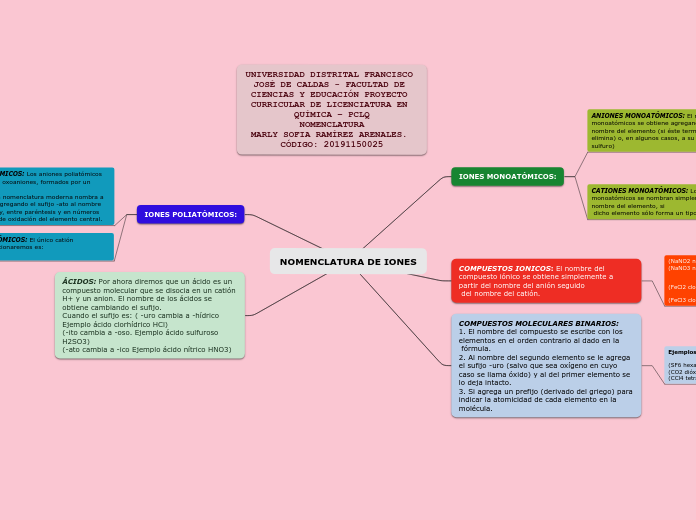
NOMENCLATURA DE IONES
La nomenclatura de los iones y compuestos químicos sigue reglas específicas para garantizar la claridad y consistencia en su identificación. Los aniones monoatómicos se nombran al añadir el sufijo -uro al nombre del elemento, mientras que los cationes monoatómicos se denominan directamente por el nombre del elemento, a menos que el elemento pueda formar más de un tipo de catión, en cuyo caso se indica la carga del ion en números romanos.