ATP
INTEGRANTES: CHRISTIAN ALEXIS MACIAS ROCHIN 4B T/M Q.F.B
BIBLIOGRAFIA: 1). Jeffrey Aronson. (19 de noviembre de 2015). The Laws of Life: Guldberg and W. cebm.net
2). Enciclopedia Salvat de las Ciencias. (1968). Química. Tomo 9, Salvat S.A. de ediciones Pamplona, España. P 13-16 3)https://es.khanacademy.org/science/biology/energy-and-enzymes/free-energy-tutorial/a/gibbs-free-energy
PH= PKa + Log (IONIZADO)/(NO IONIZADO)
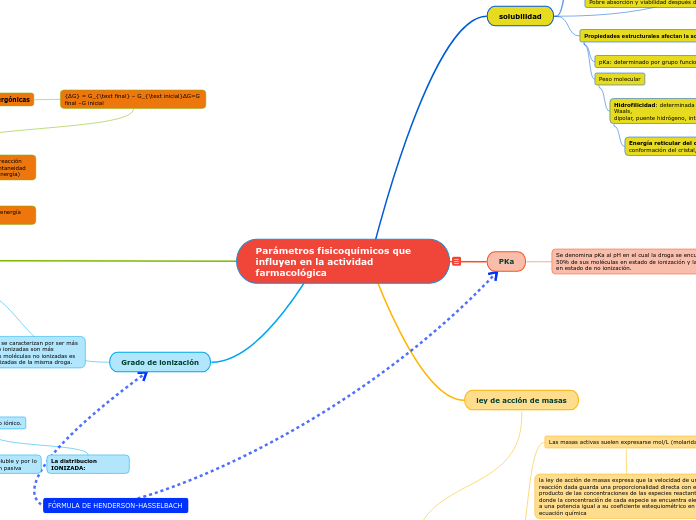
Parámetros fisicoquímicos que influyen en la actividad farmacológica
,,l
Grado de ionización
Ionización molecular
Las moléculas ionizadas (polares) se caracterizan por ser más hidrosolubles, mientras que las no ionizadas son más liposolubles:la permeabilidad a las moléculas no ionizadas es 108 veces mayor que para las ionizadas de la misma droga.
La distribucion IONIZADA:
La porcion no IONIZADA: Es usualmente liposoluble y por lo tanto puede atravesar las membranas por difusion pasiva
La mayoría de los fármacos son ácidos o bases débiles, pudiendo presentarse en los medios líquidos (como son los orgánicos) en parte ionizadas y en parte no.
Para poder calcular la fracción no ionizada de una droga en cualquier medio del organismo, es
necesario conocer:
Si la droga es un ácido o una base
El pKa de la droga
El pH del medio orgánico
Atrapamiento iónico.
Energía libre de gibbs
es una medida de la cantidad de energía utilizable (energía que puede realizar un trabajo) en ese sistema
El cambio en la energía libre de Gibbs durante una reacción provee información útil acerca de la energía y espontaneidad de la reacción (si puede llevarse a cabo sin añadir energía)
{ΔG} = G_{\text final} – G_{\text inicial}ΔG=G
final –G inicial
Reacciones endergónicas y exergónicas
Las reacciones con un ∆G positivo (∆G > 0), por otro lado, requieren de un aporte de energía y son denominadas reacciones endergónicas.
Las reacciones que tienen un ∆G negativo liberan energía libre y son denominadas reacciones exergónicas
ley de acción de masas
La ley de acción de masas establece la relación existente entre las masas activas de los reactivos y la de los productos, en condiciones de equilibrio y en los sistemas homogéneos (disoluciones o fases gaseosas).
La ley de acción de masas ha tenido muchas aplicaciones a lo largo del tiempo
K= [DR]/[D][R]
La ley de acción de masas asume que toda reacción química es de tipo elemental; en otras palabras, que la molecularidad es igual que el orden de reacción respectivo para cada especie involucrada
Las masas activas suelen expresarse mol/L (molaridad)
la ley de acción de masas expresa que la velocidad de una reacción dada guarda una proporcionalidad directa con el producto de las concentraciones de las especies reactantes, donde la concentración de cada especie se encuentra elevada a una potencia igual a su coeficiente estequiométrico en la ecuación química
aA+bB ↔ cC+dD
PKa
Se denomina pKa al pH en el cual la droga se encuentra con el 50% de sus moléculas en estado de ionización y la otra mitad en estado de no ionización.
ACIDOS-BASES
El pKa para cada grupo es distinto. Basta
que se ionice uno de los grupos en una molécula, para que la misma no pueda atravesar fácilmente la membrana, y por esto sólo nos interesa el pKa más bajo (para un ácido) o el más alto (para una base).
Tanto los ácidos como las bases pueden tener un pKa superior o inferior a 7, por lo que el pKa no define la naturaleza ácida o básica de una sustancia.
Naturaleza ácida o básica del fármaco
Es una propiedad intrínseca de cada droga y depende de su capacidad de ceder (ácido) o de aceptar (base) protones. La mayor o menor cesión o aceptación de protones es dependiente del pH del medio.
solubilidad
Propiedades estructurales afectan la solubilidad
Peso molecular
Hidrofilicidad: determinada por las uniones de Van der Waals,
dipolar, puente hidrógeno, interacciones iónicas
Energía reticular del cristal: determinado por la conformación del cristal, punto fusión
pKa: determinado por grupo funcional ionizable
Compuestos insolubles pueden interferir en el
descubrimiento.
Compuestos insolubles
• Desafíos de desarrollos (formulaciones: costosos y aumento de tiempo de desarrollo)
• Resultados de ensayos erráticos.
• Valores artificialmente bajos de actividad de bioensayos.
• Insuficiente solubilidad para administración I.V.
Pobre absorción y viabilidad después de la administración oral.
La solubilidad es una determinación de la
absorción y la viabilidad oral.
Las sales incrementan la relación de
disolución.
La solubilidad es la concentración max.
disuelta bajo condiciones de solución
La solubilidad se incrementa por agregado de
grupos ionizables