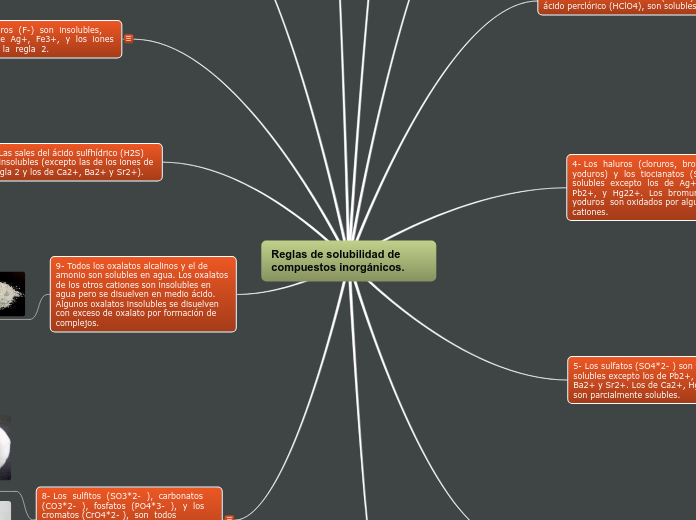
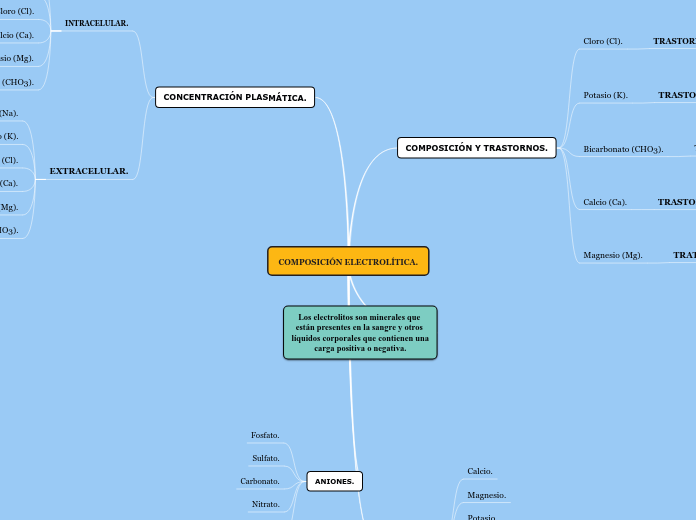
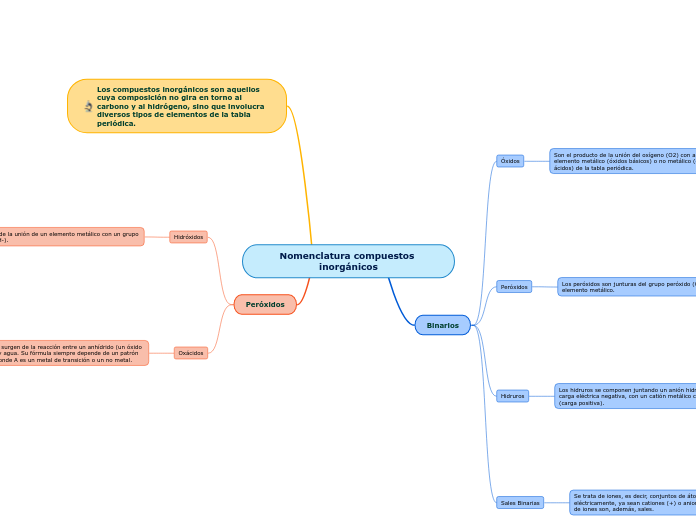
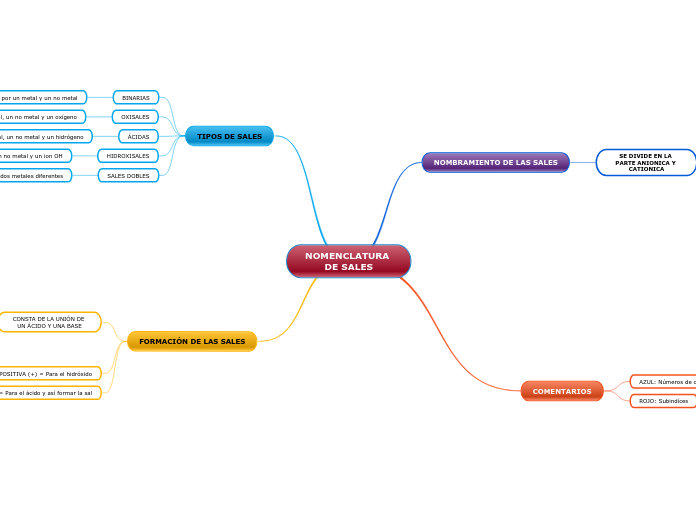
Reglas de solubilidad de compuestos inorgánicos.
8- Los sulfitos (SO3*2- ), carbonatos (CO3*2- ), fosfatos (PO4*3- ), y los cromatos (CrO4*2- ), son todos insolubles en medio básico o neutro, excepto los de los iones enlistados en la regla 2 (alcalinos y ion amonio).
Todos son solubles en medio ácido. El sulfito y el oxalato pueden formar complejos solubles. Algunos sulfitos insolubles pueden llegar a disolverse en exceso de sulfito, por formación de complejos.
Cromato
Carbonato
Sulfito
9- Todos los oxalatos alcalinos y el de amonio son solubles en agua. Los oxalatos de los otros cationes son insolubles en agua pero se disuelven en medio ácido. Algunos oxalatos insolubles se disuelven con exceso de oxalato por formación de complejos.
10- Las sales del ácido sulfhídrico (H2S) son insolubles (excepto las de los iones de la regla 2 y los de Ca2+, Ba2+ y Sr2+).
11- Los fluoruros (F-) son insolubles, excepto los de Ag+, Fe3+, y los iones enlistados en la regla 2.
Algunos fluoruros de los metales de transición son
solubles, especialmente en exceso de fluoruro, debido a la formación de complejos.
12- Los ferrocianuros (Fe(CN)6*4-) son insolubles, excepto los de los iones enlistados en la regla 2.
13- Los hidróxidos (OH-) son insolubles, excepto los de Sr2+, Ba2+, Ca2+ y los de los iones enlistados en la regla 2. .
Muchos de los hidróxidos insolubles se vuelven solubles en exceso de hidróxido, debido a la formación de compuestos de coordinación (complejos).
7- Los tiosulfatos (S2O3*2- ) son solubles, excepto los de Pb2+, Ba2+, y Ag+.6
El tiosulfato de plata: Ag2S2O3, se descomponen en exceso de tiosulfato, con reducción de la plata a plata metálica.
6- Los nitritos (NO2-) y permanganatos (MnO4- ) son solubles excepto el nitrito de plata (AgNO2).
Estos iones son agentes oxidantes poderosos, así que son
inestables cuando se encuentran con cationes que son fácilmente oxidados.
Nitrito
Permanganato
5- Los sulfatos (SO4*2- ) son todos solubles excepto los de Pb2+, Hg2+ , Ba2+ y Sr2+. Los de Ca2+, Hg22+ y Ag+, son parcialmente solubles.
4- Los haluros (cloruros, bromuros y yoduros) y los tiocianatos (SCN-) son solubles excepto los de Ag+, Tl+, Pb2+, y Hg22+. Los bromuros y yoduros son oxidados por algunos cationes.
Haluros
Tiocianato
3- Las sales del ácido clórico (HClO3) y del ácido perclórico (HClO4), son solubles.
2- Las sales de los cationes del grupo I (sodio, potasio, rubidio y cesio, ha excepción del litio) y del ion amonio son solubles.
1- Todos los nitratos son solubles.