arabera CHRISTIAN ORLANDO RODRIGUEZ RODRIGUEZ 4 years ago
468
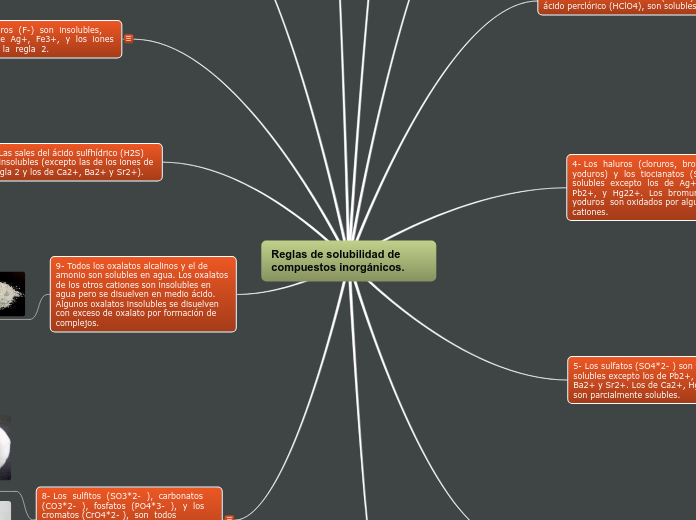
Reglas de solubilidad de compuestos inorgánicos.
Las reglas de solubilidad de los compuestos inorgánicos establecen criterios específicos para determinar si una sustancia se disolverá en agua. Los fluoruros son generalmente insolubles, con algunas excepciones notables como los fluoruros de metales de transición en exceso de fluoruro debido a la formación de complejos.