realizată de Simeon Tsanev 9 ani în urmă
593
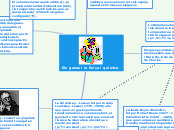
Fisica i quimica: gassos al poder
La teoria cinètica dels gasos es dedica a explicar el comportament i les propietats macroscòpiques de la matèria mitjançant una descripció estadística dels processos moleculars microscòpics.