realizată de Aurora Anaid García Martínez 4 ani în urmă
408
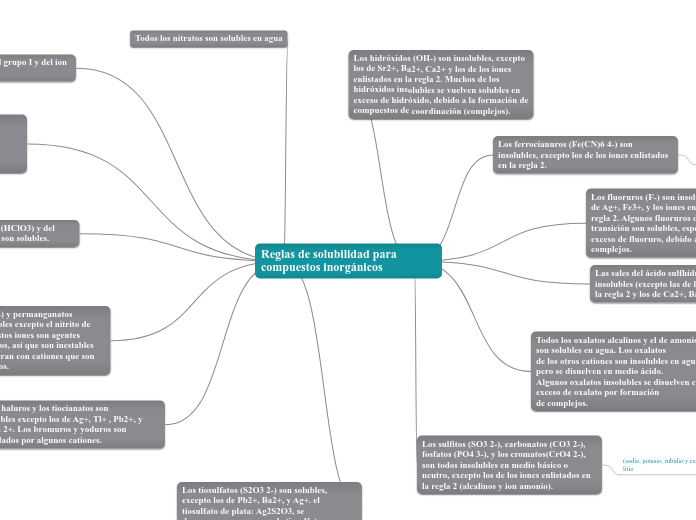
Reglas de solubilidad para compuestos inorgánicos
Las reglas de solubilidad para compuestos inorgánicos determinan cuáles sustancias se disuelven en agua y cuáles no. Los nitratos siempre son solubles, mientras que los sulfatos tienen excepciones dependiendo del ion con el que estén combinados.