по Ana Paola Félix González 3 лет назад
242
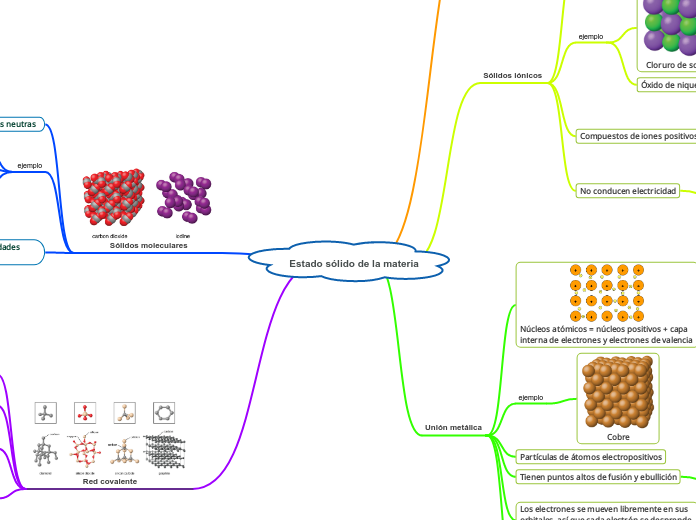
Estado sólido de la materia
Los sólidos pueden clasificarse en diferentes tipos según la estructura y los enlaces que los componen. Los sólidos cristalinos, como los metales y compuestos iónicos, presentan un patrón repetido y ordenado en la disposición de sus átomos o moléculas.