作者:Isayda Carrasco Lachira 3 年以前
246
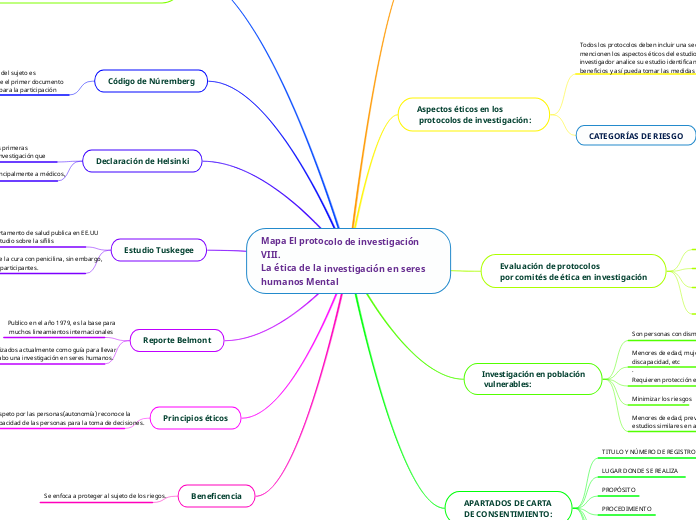
Mapa El protocolo de investigación VIII. La ética de la investigación en seres humanos Mental
El protocolo de investigación aborda la importancia de la ética en la realización de estudios en seres humanos, destacando la relevancia del consentimiento voluntario establecido en el Código de Núremberg de 1948.