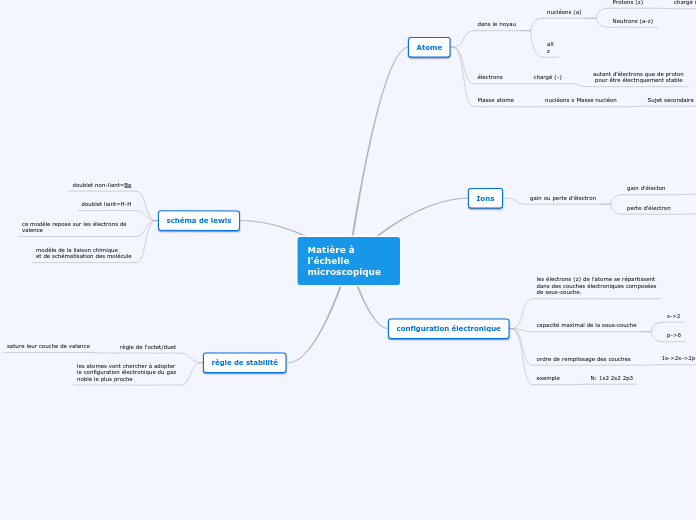
Matière à l'échelle microscopique
règle de stabilité
les atomes vont chercher à adopter
le configuration électronique du gaz
noble le plus proche
règle de l'octet/duet
sature leur couche de valance
schéma de lewis
modèle de la liaison chimique
et de schématisation des molécule
ce modèle repose sur les électrons de valence
doublet liant=H-H
doublet non-liant=Be
configuration électronique
exemple
N: 1s2 2s2 2p3
ordre de remplissage des couches
1s->2s->2p->3s->3p...
capacité maximal de la sous-couche
p->6
s->2
les électrons (z) de l'atome se répartissent
dans des couches électroniques composées
de sous-couche.
Ions
gain ou perte d'électron
perte d'électron
Ion positif=cation
gain d'électon
Ion négatif=anion
Atome
Masse atome
nucléons x Masse nucléon
Sujet secondaire
électrons
chargé (-)
autant d'électrons que de proton
pour être électriquement stable
dans le noyau
aX
z
nucléons (a)
Neutrons (a-z)
Protons (z)
chargé (+)