af Sara Morales 4 år siden
226
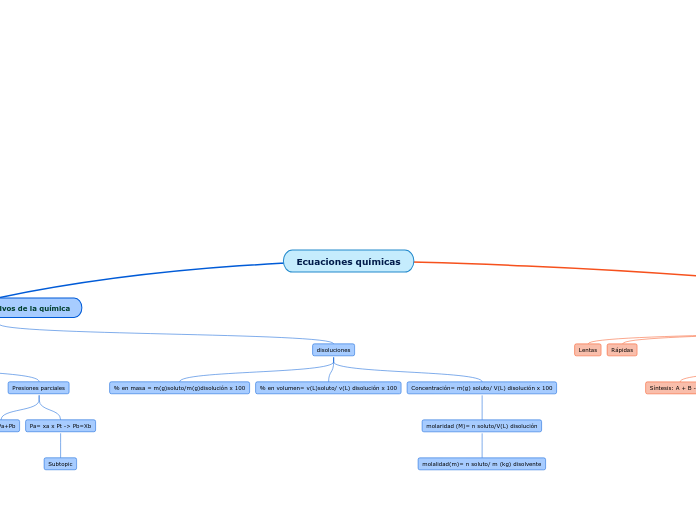
Ecuaciones químicas
Los aspectos cuantitativos de la química incluyen diversas ecuaciones y principios que permiten entender y predecir comportamientos de sustancias y reacciones. Las ecuaciones de gases ideales, como PxV=nRT, permiten calcular variables como presión, volumen, y temperatura.